Mục tiêu: cung cấp cho người đọc thông tin tổng quan các kết quả nghiên cứu trong và ngoài nước của 6 bệnh gồm các mục: giới thiệu chung, lịch sử và địa dư bệnh, căn bệnh, dịch tễ học, triệu chứng, bệnh tích, chẩn đoán, biện pháp phòng và can thiệp.
1.1. BỆNH THIẾU MÁU TRUYỀN NHIỄM Ở GÀ (Chicken Infectious Anemia)
1.1.1. Giới thiệu chung
Bệnh thiếu máu truyền nhiễm ở gà (Chicken Infectious Anemia, CIA) gây tình trạng thiếu máu không tái tạo (aplastic anemia) do sự phá hủy các tế bào tạo máu (hematopoietic stem cell – tế bào gốc trong tủy xương qua quá trình biệt hóa thành các dòng tế bào máu) và thoái hóa các mô lympho (lymphoid depletion) (Mcnulty, 1991). Bên cạnh đó, do tình trạng ức chế miễn dịch (immunosuppression), gà bị bệnh thiếu máu truyền nhiễm dễ mắc bệnh kế phát, giảm đáp ứng với các loại vacxin phòng bệnh (Hagood & cs, 2000). Sự xuất hiện của CIA được đánh giá là một trong những mối đe dọa nghiêm trọng cho ngành chăn nuôi gà ở nhiều nước trên thế giới (Mcnulty, 1991; Balamurugan & Kataria, 2006).
Thiệt hại kinh tế do bệnh thiếu máu truyền nhiễm gây ra
Nghiên cứu tại Israel (Davidson & cs, 2004) khi quan sát 6 đàn gà thịt cho thấy nhiễm CIAV làm giảm sức sản xuất, tăng trưởng kém hơn, tỷ lệ tử vong cao hoặc tăng triệu chứng của các bệnh trong trường hợp nhiễm ghép. Cụ thể, nghiên cứu đã chỉ ra dấu hiệu giảm tổng khối lượng 35.000 kg của một đàn so với hai đàn khác có biểu hiện của bệnh thiếu máu truyền nhiễm (viêm da, xuất huyết cơ, tủy xương nhạt màu, tỷ lệ tử vong cao). Bên cạnh đó, tỷ lệ tử vong ở các đàn nhiễm CIAV tăng cao gấp 4 lần so với đàn bình thường.
Khi gà bị nhiễm nhiều loại mầm bệnh, ví dụ như CIAV với MDV, REV (reticuloendotheliosis virus) hoặc IBDV,… sẽ làm cho tỷ lệ ốm và tỷ lệ chết tăng cao. Bệnh thường xảy ra với đàn gà từ 2 – 4 tuần tuổi khiến cho gà chậm phát triển, tỷ lệ chết dao động từ 10 – 20%, có trường hợp lên đến 60%. Với gà trên 6 tuần tuổi, bệnh thường liên quan đến hội chứng thiếu máu – xuất huyết (aplastic anemia – hemorrhagic syndrome).
CIA và các hội chứng có liên quan thường được biết đến với một số tên gọi như hội chứng xuất huyết (hemorrhagic syndrome), chứng viêm da – thiếu máu (anemia – dermatitis) và bệnh cánh xanh (blue wing disease).
Bệnh thiếu máu truyền nhiễm gây thiệt hại kinh tế, giảm lợi nhuận khoảng 18,5% do giảm tăng trọng, tăng tỷ lệ chết của gà từ 3- 15 tuần tuổi (Mcilroy & cs, 1992). Tuy nhiên, đối với ngành sản xuất trứng gà sạch, bệnh thường gây ra những khó khăn và ảnh hưởng lớn nhất bởi Ủy ban châu Âu yêu cầu trứng để sản xuất vacxin dùng cho gà dưới 7 ngày tuổi không được tạp nhiễm CIAV. Ngoài ra, tại Úc, châu Âu và Mỹ, chỉ những trứng sạch CIAV mới được dùng để sản xuất vacxin phòng bệnh quai bị và sởi cho người. Bên cạnh đó, chi phí bỏ ra để đảm bảo và duy trì các biện pháp an toàn sinh học là không nhỏ bởi virus có sức đề kháng mạnh với các hóa chất sát trùng (Toro & cs, 2006). Đứng ở khía cạnh này, CIAV gián tiếp gây ra các thiệt hại về kinh tế do phải áp dụng các biện pháp an toàn sinh học nghiêm ngặt trong quá trình nuôi.
1.1.2. Lịch sử và địa dư bệnh
Lịch sử phát hiện bệnh thiếu máu truyền nhiễm gắn với sự phát hiện CIAV (chủng Gifu-1) lần đầu tiên năm 1979 ở Nhật Bản (Yuasa, 1983). Tiếp sau đó, CIAV đã được phân lập ở nhiều nước: chủng ConnB được phân lập từ gà bị bệnh Marek’s (Goryo & cs, 1987); chủng CIA-1 được phân lập năm 1988 tại một trang trại ở Delaware (Mỹ) (Lucio & cs, 1990); chủng Cux-1 (C) được phân lập ở Cuxhaven (Đức) vào năm 1991 (Chandratilleke & cs, 1991); chủng L-028 được phân lập vào năm 1992 tại một trang trại ở New York (Mỹ) (Renshaw & cs, 1996)… Bằng phản ứng huyết thanh học, CIAV được xác định có mặt ở khắp các nước, ví dụ như ở Nhật Bản, Trung Quốc, Mỹ, Úc, NewZealand và Nam Phi…. Nghiên cứu hồi cứu các mẫu huyết thanh thu thập từ 1959- 2005 cho biết nhiều khả năng virus đã hiện diện từ trước những năm 1970 (Toro & cs, 2006).
Ghi chú: dựa vào thông tin được công bố qua các bài báo khoa học, trình tự gen được công bố trên GenBank, đã xác định được các quốc gia có sự hiện diện của CIAV (đánh dấu)
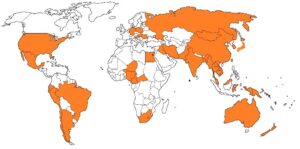
Hình 1.1. Bản đồ phân bố của CIAV ở các nước trên thế giới
Cho đến nay CIAV và bệnh thiếu máu truyền nhiễm đã có mặt ở nhiều nước thuộc tất cả các châu lục (hình 1.1). Ở khu vực Đông Nam Á, CIAV đã được xác định ở Thái Lan, Campuchia, Lào, Malaysia, Indonesia và Việt Nam (Hailemariam & cs, 2008; Kye & cs, 2013; Wanasawaeng & cs, 2013; Trinh & cs, 2015b).
Virus gây bệnh thiếu máu truyền nhiễm ở gà (chicken infectious anemia virus- CIAV) lần đầu tiên được phát hiện từ đàn gà thương phẩm bị bệnh ở Nhật Bản (Yuasa & cs, 1979) với tên ban đầu là CAA (chicken anemia agent- yếu tố gây thiếu máu ở gà). Tên gọi CAA bắt nguồn từ đặc điểm tác nhân gây bệnh không nhân lên trên một số môi trường nuôi cấy tế bào (Yuasa, 1983). Về sau, CAA được chứng minh là một virus khi phát hiện ra tác nhân này nhân lên trên một số dòng tế bào lymphoblastoid của gà (Yuasa & cs, 1983). Sau khi được chứng minh là virus, tên gọi CAV hoặc CIAV được dùng thay cho CAA (Mcnulty, 1991; Noteborn & cs, 1991; Meehan & cs, 1992).
1.1.3.1. Phân loại
Về phân loại, trước đây, CIAV được xếp vào giống Gyrovirus và họ Circoviridae (Meehan & cs, 1992). Năm 2017, trên cơ sở phân tích lại một cách có hệ thống các bằng chứng về sự khác biệt rõ rệt của CIAV với virus thuộc họ Circoviridae, ủy ban quốc tế về phân loại virus (ICTV), đã chuyển CIAV và giống Gyrovirus vào họ Anelloviridae (Rosario & cs, 2017).
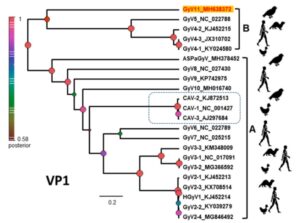
Hình 1.2. Cây phát sinh chủng loại của giống Gyrovirus
Nguồn: Truchado & cs. (2019)
Trước năm 2011, CIAV là thành viên duy nhất của giống Gyrovirus được biết đến. Hiện tại, đã xác định được 12 virus, bao gồm GyV2 -GyV10, HGyV1 (Human Gyrovirus), ASPaGyV (Ashy storm petrel Gyrovirus) và GyV11 (Truchado & cs, 2019); mối liên hệ giữa các thành viên được trình bày ở hình 1.2. Dựa vào đặc điểm phân nhánh, CIAV (đóng khung, hình 1.2) là một nhánh độc lập trong giống Gyrovirus, có quan hệ gần gũi với GyV6 và GyV7.
1.1.3.2. Hình thái, cấu trúc CIAV
Dưới kính hiển vi điện tử, hình ảnh nhuộm âm bản CIAV tinh khiết cho thấy hạt virus có dạng hình cầu, với khoảng 10 gai nhô lên rõ ràng trên bề mặt.
CIAV là một virus không có vỏ bọc, đường kính trung bình từ 19,1nm – 26,5nm (Gelderblom & cs, 1989). Cấu trúc bề mặt capsid có 60 tiểu đơn vị (capsome) được sắp xếp theo 12 vòng hình loa kèn.
Về vật chất di truyền, bộ gen CIAV là sợi ADN đơn, dạng vòng, dài khoảng 2,3 kb. Bộ gen CIAV có 3 khung đọc mở (ORF) lồng một phần vào nhau, theo thứ tự ORF2- ORF3- ORF1. Trong đó ORF2, ORF3 và ORF1 mã hóa lần lượt cho 3 protein là: VP2 (24 kDa), VP3 (14 kDa) và VP1 (52 kDa) (Noteborn & cs, 1991).
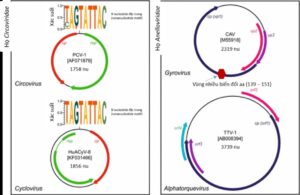
Hình 1.3. Cấu trúc bộ gen CIAV
Nguồn: Rosario & cs. (2017)
Khi so sánh cấu trúc gen giữa thành viên của họ Circoviridae và Anelloviridae thấy virus thuộc họ Anelloviridae có đặc điểm (i) gen mã hóa protein lồng nhau và cùng chiều, (ii) không có cấu trúc stem-loop; trong khi đó ở các thành viên của họ Circoviridae (i) gen mã hóa protein lồng nhau và ngược chiều, (ii) có cấu trúc stem-loop với 9 nucleotide đặc trưng (hình 1.3).
Trong số 3 protein virus, VP1 là protein cấu trúc duy nhất được biết đến có vai trò tạo thành capsid, được phát hiện trong các hạt virus có độ tinh khiết cao, đóng vai trò quan trọng trong việc tạo ra kháng thể trung hòa ở gà bị nhiễm bệnh. VP2 là protein không cấu trúc, có thể hoạt động như một protein làm khung (scaffold) trong quá trình lắp ráp virion (Noteborn & cs, 1998). VP2 còn có hoạt tính của phosphatase (dual-specificity phosphatase) nhận biết đặc hiệu đồng thời phân tử tyrosine, serine hoặc threonine ở vị trí cắt (Peters & cs, 2002). VP3 là protein không cấu trúc hay là 1 apoptin gây ra cơ chế chết chương trình hóa (apoptosis) cho các tế bào tiền thân ở vùng tủy của tuyến ức và các tế bào hemocytoblasts trong tủy xương (Noteborn & cs, 1994).
1.1.3.3. Sức đề kháng của CIAV
Nhìn chung, virus có sức đề kháng cao trong điều kiện tự nhiên. CIAV có đặc tính của một virus không có vỏ bọc, ví dụ đề kháng cao với nhiệt độ, chloroform (Yuasa, 1992). CIAV chịu được nhiệt độ 56oC hoặc 70oC trong 1 giờ và 80oC trong 15 phút (Natesan & cs, 2006). Virus bị bất hoạt một phần sau khi đun ở 80oC trong 30 phút và bất hoạt hoàn toàn sau 15 phút ở 100oC. Vì vậy, sản phẩm gà bệnh yêu cầu xử lý ở 95oC trong vòng 30 phút hoặc ở 100oC trong 10 phút (Urlings & cs, 1993). Đối với các hóa chất dùng sát trùng, CIAV trong huyễn dịch bệnh phẩm bị bất hoạt hoàn toàn bởi iodine hoặc sodium hypochlorite, nhưng yêu cầu trong 2 giờ ở 37oC với nồng độ chất sát trùng 10% thay vì như thông thường chỉ 2% (Yuasa, 1992). Virus có thể chịu được pH = 3 trong 24 giờ, vì vậy chất sát trùng pH = 2 thường được sử dụng để diệt CIAV.
.1.3.4. Tính kháng nguyên và sự biến đổi chủng của CIAV
Sử dụng kháng thể đa dòng, các nhà khoa học trên thế giới không phát hiện sự khác nhau về đặc tính kháng nguyên giữa các chủng CIAV phân lập được ở Nhật Bản, châu Âu và châu Mỹ (Yuasa & Imai, 1986; Mcnulty & cs, 1990). Với kháng thể đơn dòng, sự khác biệt nhỏ về đặc tính kháng nguyên giữa các chủng CIAV đã được tìm thấy (Trinh & cs, 2015a). Trên capsid protein của CIAV tồn tại vùng “siêu biến đổi” từ amino acid 139 đến 151, nhưng mới chỉ có bằng chứng về sự thay đổi amino acid của vùng này đến đặc tính nhân lên của CIAV in vitro (Renshaw & cs, 1996).
Dựa vào phản ứng huyết thanh học, nhìn chung các chủng CIAV được xem thuộc về một type huyết thanh đơn. Năm 2002, một nhóm nhà khoa học ở Mỹ công bố phát hiện virus CIAV-7 phân lập từ gà 17 tuần tuổi có bệnh tích của bệnh thiếu máu truyền nhiễm. Trong điều kiện thí nghiệm, CIAV-7 gây ra tình trạng bệnh giống bệnh thiếu máu truyền nhiễm, nhưng CIAV-7 lại có đặc tính kháng nguyên khác với chủng CIAV tham chiếu (không bị trung hòa bởi kháng thể đặc hiệu kháng CIAV chủng Del-Ros). Do đó, chủng CIAV-7 được giả định là một type huyết thanh học thứ 2 của virus gây bệnh thiếu máu truyền nhiễm (Spackman & cs, 2002). Tuy nhiên, cho đến nay, vẫn chưa có thêm nghiên cứu về CIAV-7 được công bố.
Gà là vật chủ chính của CIAV mặc dù gà tây và chim cút ở Nhật Bản có thể nhiễm CIAV. CIAV không chỉ được phát hiện ở các đàn gà thịt mà ở cả các đàn gà SPF (Cardona & cs, 2000). Gà trống và mái đều mẫn cảm; gà giống thịt được cho rằng mẫn cảm hơn với bệnh. Gà ở các lứa tuổi đều cảm nhiễm với CIAV nhưng giai đoạn sau 2 tuần tuổi sự mẫn cảm với bệnh giảm nhanh do sự hoàn thiện của hệ miễn dịch (immuno competency), trong đó gà 1 ngày tuổi mẫn cảm nhất. Từ 2012 trở lại đây, bằng phương pháp PCR, tại Trung Quốc đã phát hiện được CIAV từ phân của người (Zhang & cs, 2012), chuột, chó hoang (Fang & cs, 2017) và mèo (Niu & cs, 2019). Mặc dù vậy, các loài này chưa được chứng minh là vật chủ của CIAV (Fang & cs, 2017).
1.1.4.2. Phương thức truyền lây
Có 2 phương thức truyền lây gồm truyền dọc và truyền ngang. Một lượng lớn CIAV được bài thải qua phân từ các gà nhiễm bệnh (Imai & cs, 1999); vì vậy, phân gà được xem là một nguồn lây nhiễm quan trọng. Theo nghiên cứu trên, truyền ngang thông qua tiếp xúc trực tiếp/gián tiếp với virus qua đường miệng; cách lây nhiễm này chủ yếu xảy ra ở gà không có kháng thể mẹ truyền trong giai đoạn từ 2- 4 tuần tuổi, hiện tượng chuyển dương tính huyết thanh học xảy ra ở giai đoạn 8- 12 tuần tuổi.
CIAV có thể lây lan theo đường truyền dọc từ bố mẹ qua trứng, do đó việc ngăn chặn bệnh xảy ra trong môi trường chăn nuôi gà trở nên khó khăn. Trong tự nhiên, sự lây truyền dọc thường xuất hiện trong 3- 9 tuần sau khi gà tiếp xúc với CIAV, giai đoạn lây nhiễm cao nhất là từ 1- 3 tuần.
Giai đoạn đầu (6-8 ngày) sau khi gây nhiễm, đầu tiên xuất hiện hiện tượng dung giải của tiền tế bào máu ở tủy xương và tế bào tiền lympho ở phần vỏ tuyến ức, khiến cho con vật bị thiếu máu nhanh chóng. Bên cạnh các tế bào tiền hồng cầu bị trương phồng và tế bào tạo máu (hematopoitic cell) bị phân hủy, đại thực bào tiêu nuốt tế bào hematopoitic bị phân hủy cũng được tìm thấy trong tủy xương. Sự dung giải tế bào lympho và hiện tượng hoại tử của túi Fabricius, lách, hạch lympho chỉ quan sát được sau khi gây nhiễm 10 – 12 ngày. Khoảng 16 ngày sau khi gây nhiễm, khi cơ thể sản sinh đáp ứng miễn dịch, các tiền tế bào của tuyến ức và tủy xương bắt đầu được phục hồi, con vật dần khỏi sau 32 – 36 ngày.
Bệnh thiếu máu truyền nhiễm ở gia cầm là kết quả của việc phá hủy các tế bào hồng cầu, làm teo tuyến ức, dẫn đến làm cạn kiệt các tế bào miễn dịch của tuyến ức. CIAV là nguyên nhân gây ức chế miễn dịch và làm teo cơ quan sinh miễn dịch ở gia cầm nhỏ, đặc biệt là gây giảm đáng kể tế bào lympho (CD4+) và (CD8+) của tuyến ức và còn tác động tới nhiều lớp tế bào lympho khác. CIAV gây biến đổi bệnh lý tập trung ở các mô và tế bào lympho, đặc biệt là tuyến ức. Gà bệnh thường có tủy xương có màu nhạt và có sự thâm nhiễm mỡ, đây là các tổn thương tiêu biểu nhất của bệnh (Pope 1991). CIAV tái tạo chính trong các tế bào máu tiền thân ở trong tủy xương và các tế bào tuyến ức tiền thân ở vùng vỏ của tuyến ức, gây chết tế bào bằng cơ chế apoptosis (cơ chế chết tự nhiên) (Adair 2000).
Cho đến nay, nhiều nghiên cứu cho thấy khả năng gây thiếu máu của CIAV phụ thuộc trực tiếp vào liều virus nhiễm, tuổi gia cầm nhiễm và sự kế phát của các yếu tố gây bệnh khác (Yuasa & cs, 1988). Ngoài ra, các tác nhân gây ức chế miễn dịch có tác dụng hiệp đồng với CIAV làm bệnh tiến triển ở thể nặng. Bằng thực nghiệm, người ta đã chứng minh rằng IBDV ức chế và làm giảm cường độ sự sản sinh kháng thể trung hòa chống lại CIAV, dẫn tới lượng CIAV huyết cao, trong khoảng 102,5 đến 105,5 TCID50/0,1 ml (Imai & cs, 1999). Nhiễm ghép IBDV còn kéo dài độ tuổi mẫn cảm của gà đối với CIAV (Rosenberger & Cloud, 1989).
Triệu chứng lâm sàng của bệnh thiếu máu truyền nhiễm phụ thuộc vào nhiều yếu tố như: lứa tuổi, tình trạng miễn dịch; liều lượng và đường xâm nhập của virus. Hình 1.4 trình bày tóm tắt mối tương quan giữa biểu hiện bệnh, lứa tuổi và tình trạng miễn dịch. Gà ở mọi lứa tuổi đều mẫn cảm với CIAV (virus gây ra tình trạng nhiễm trùng) (Kaffashi & cs, 2006); tuy nhiên, gà càng lớn khả năng mắc bệnh thiếu máu truyền nhiễm càng giảm (age resistance) (Mcnulty, 1991). Gà trên 3 tuần tuổi sau khi nhiễm CIAV thường sản sinh đáp ứng miễn dịch có khả năng bảo hộ, ngăn cản tiến triển thành thể bệnh lâm sàng. Mặc dù vậy, đặc tính đề kháng theo lứa tuổi có thể bị phá vỡ nếu trong giai đoạn này gà bị nhiễm các virus gây ức chế miễn dịch (ví dụ như IBDV) làm cho khả năng sản sinh đáp ứng miễn dịch chống lại CIAV bị giảm sút, dẫn tới tiến triển bệnh ở thể lâm sàng (vùng E, hình 1.4) (Mcnulty, 1991). Gà dưới 3 tuần tuổi nhiễm CIAV thường mắc bệnh rất điển hình (Yuasa & cs, 1979). Trường hợp có kháng thể thụ động ở ngưỡng bảo hộ, hiệu giá kháng thể trung hòa ≥ 40 (vùng A, hình 1.4), gà con dù ở lứa tuổi mẫn cảm vẫn không mắc bệnh ở thể lâm sàng.
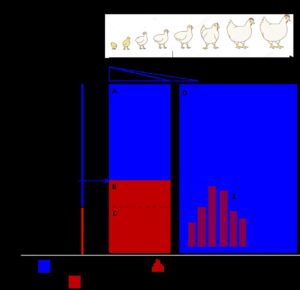
Hình 1.4. Tương quan giữa biểu hiện bệnh, lứa tuổi và tình trạng miễn dịch trong bệnh thiếu máu truyền nhiễm
Khi bệnh xảy ra ở thể cấp tính, thời gian ủ bệnh từ 1- 14 ngày. Ngoài các triệu chứng không điển hình (ủ rũ, xù lông, giảm ăn), gà bệnh có biểu hiện thiếu máu như mào yếm nhợt nhạt (Yuasa & cs, 1979; Adair, 2000). Tỷ lệ chết thường từ 5- 10% (trong 2- 4 tuần sau khi nhiễm) nhưng có thể lên tới 60% trong trường hợp kế phát bệnh khác (Balamurugan & Kataria, 2006). Nếu sống sót qua giai đoạn này, các gà sẽ dần hồi phục sau 4- 5 tuần nhiễm bệnh. Thông thường, các triệu chứng sẽ biểu hiện nặng nề khi có sự kế phát các mầm bệnh khác, đặc biệt là virus gây suy giảm miễn dịch (Adair, 2000). Điển hình là các trường hợp nhiễm kế phát với MDV (Miles & cs, 1999), với IBDV (Imai & cs, 1999), FAdV (Toro & cs, 2001), reovirus (Mcneilly & cs, 1995) và NDV (De Boer & cs, 1994).
Một số báo cáo cho biết gà có triệu chứng tụ máu dưới da cánh (đặc biệt khủy cánh) nên bệnh có tên là bệnh cánh xanh hoặc chảy máu từ lỗ chân lông ống của đuôi và cánh (Gowthaman, 2019).
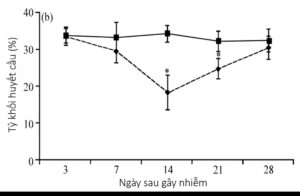
Chỉ tiêu phi lâm sàng của tình trạng thiếu máu là tỷ khối huyết cầu giảm, dao động từ 6 – 27% (Balamurugan & Kataria, 2006). Ở gà khỏe mạnh, tỷ khối huyết cầu thường lớn hơn 27% mặc dù chỉ số này cũng thay đổi tùy theo từng giống gà. Ví dụ gà giống trứng có chỉ số PCV (Packed cell volume) thấp hơn gà giống thịt; gà càng lớn thì chỉ số này càng giảm. Khi gà bị bệnh thiếu máu truyền nhiễm, máu gà có thể loãng hơn, thời gian đông máu chậm, tương bào nhạt hơn bình thường. Chỉ số PCV xuống dưới 27% sau khi gây nhiễm 8 – 10 ngày, dao động từ 10 – 20% ở ngày 14 – 20 và thậm chí có thể xuống dưới 6% ở những gà gần chết. Ở những gà hồi phục, sau 6 – 21 ngày chỉ số PCV bắt đầu tăng trở lại, về mức bình thường (29 – 35%) sau khi nhiễm 28 – 35 ngày (Dhama & cs, 2008).
|
Hình 1.6. Biến động tỷ khối huyết cầu ở gà mắc bệnh
Nguồn: Wani & cs (2014)
Bằng gây bệnh thực nghiệm, tỷ khối huyết cầu của nhóm gây nhiễm (đường nét đứt, hình 1.6) giảm so với nhóm đối chứng. Sự giảm này rõ nhất sau gây nhiễm 14 ngày với tỷ khối huyết cầu trung bình ở nhóm gây nhiễm là 18,22 ± 2,22 trong khi đó của nhóm đối chứng là 34,12 ± 4,72 (Wani & cs, 2014). Nguyên nhân dẫn đến chỉ số PCV giảm là do hiện tượng giảm tế bào máu, bao gồm giảm số lượng hồng cầu, bạch cầu và tiểu cầu – hậu quả khi các tiền tế bào máu bị dung giải rất sớm (3 – 4 ngày sau khi gây nhiễm). Khi gà qua khỏi, công thức máu sẽ trở lại bình thường sau 40 ngày.
1.1.6. Bệnh tích
Teo cơ quan lympho nói chung, đặc biệt là tuyến ức và biểu hiện tủy xương nhạt màu (hình 1.7) được xem là bệnh tích đại thể đặc trưng nhất (Yuasa & cs, 1979; Mcnulty, 1991). Ngoài ra, có một số biến đổi khác như: xuất huyết, tụ máu ở tổ chức liên kết dưới da; gan sưng, nhạt màu hoặc vàng nhạt (Yuasa & cs, 1979).
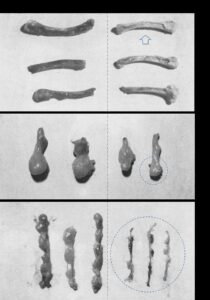
Hình 1.7. Bệnh tích đại thể ở gà mắc bệnh thiếu máu truyền nhiễm
Nguồn: Yuasa & cs (1979)
Có một vấn đề cần chú ý là: khi gà nhiễm CIAV gây ra tình trạng suy giảm miễn dịch nghiêm trọng và gà dễ mẫn cảm với các mầm bệnh là virus như MDV (Miles & cs, 1999); IBDV (Imai & cs, 1999); FAdV4 (Toro & cs, 2001); Reovirus (Mcneilly & cs, 1995) và NDV (De Boer & cs, 1994) dẫn tới những ảnh hưởng hiệp đồng của các yếu tố. Chính vì vậy, bệnh tích ở gà mắc bệnh thiếu máu truyền nhiễm khi bị nhiễm ghép có sự thay đổi, khác với trường hợp nhiễm đơn.
Chẩn đoán lâm sàng bệnh thiếu máu truyền nhiễm có thể dựa vào lịch sử đàn giống, tình trạng hoặc dấu hiệu lâm sàng, kết luận về huyết học và bệnh tích mổ khám. Chẩn đoán lâm sàng dựa vào các dấu hiệu điển hình ở gà bệnh trong giai đoạn mẫn cảm và các bệnh tích phản ánh hiện tượng thiếu máu, ví dụ như: mào, tích nhợt nhạt, gan sưng và nhạt màu, thận nhạt màu, tủy xương nhạt màu và mô lympho tập trung bị teo (túi Fabricius, tuyến ức).
1.1.7.2. Chẩn đoán phi lâm sàng
- Phương pháp phân lập virus:
CIAV có khả năng nhân lên và được phân lập ở gà SPF mẫn cảm, trong phôi gà và trong nuôi cấy tế bào (Yuasa & cs, 1979; Mcnulty, 1991; Balamurugan & Kataria, 2006); trong khi đó thời điểm 12- 16 ngày sau khi gây nhiễm CIAV cho gà lớn thấy có biểu hiện bệnh tích. Trong phôi gà, CIAV nhân lên ở túi lòng đỏ nhưng hiệu giá virus không đủ cao để gây chết phôi hoặc gây ra các tổn thương điển hình của bệnh. Tuy nhiên, gà con mới nở mang các dấu hiệu của bệnh. CIAV không nhân lên được trong các môi trường nuôi cấy tế bào thông thường nhưng phát triển được trong một số dòng tế bào lympho hình thành trong bệnh Marek’s và bệnh gây khối u lympho (Renshaw & cs, 1996). Cho đến nay, dòng tế bào được sử dụng phổ biến cho việc phân lập CIAV là dòng tế bào MDCC-MSB1 lấy từ khối u lympho ở lách của gà bị bệnh Marek’s. Các chủng virus có thể gây nhiễm khác nhau cho các dòng tế bào phụ như MDCC-CU147, khi đó dòng tế bào T (lấy từ tổn thương cục bộ của MD) được báo cáo nhạy cảm nhất để phân lập virus, có thể sản xuất ra một lượng virus gấp từ 10- 100 lần so với dòng MSB1.
- Kỹ thuật PCR:
PCR được ứng dụng từ rất sớm để phát hiện CIAV, mồi đặc hiệu được thiết kế phát hiện trình tự gen bảo thủ mã hóa protein VP2. Ở những vùng đã sử dụng vacxin nhược độc phòng bệnh thiếu máu truyền nhiễm, việc sử dụng cặp mồi kể trên không cho phép phân biệt giữa chủng virus vacxin và chủng virus gây bệnh. Đã có nhiều nghiên cứu sử dụng cặp mồi nhân lên toàn bộ gen mã hóa protein VP1 của virus, sau đó cắt bằng enzyme cắt giới hạn (Van Santen & cs, 2001).
- Phương pháp chẩn đoán huyết thanh học
Đối với việc phát hiện kháng thể: ELISA, VNT và IFA là những kỹ thuật được sử dụng phổ biến nhất (Dhama & cs, 2002) bởi kháng thể kháng CIAV là dấu hiệu tồn tại trước đó của CIAV, trong đó phản ứng miễn dịch huỳnh quang gián tiếp và ELISA có thể được áp dụng để phát hiện kháng thể kháng CIAV (Rosenberger & Cloud, 1989). Hiện nay, các kit ELISA được sử dụng phổ biến để sàng lọc các đàn giống nghi nhiễm virus trước khi vào giai đoạn đẻ trứng. Kỹ thuật ngưng kết gián tiếp bằng hạt nhựa (blocking latex agglutination test) cũng đã được phát triển và cho kết quả tương đồng 93,6% so với phản ứng trung hòa (Trinh & cs, 2015b).
1.1.7.3. Chẩn đoán phân biệt
Cần tiến hành các chẩn đoán phân biệt với các bệnh Marek’s, Gumboro, bệnh do FAdV4 gây ra, bệnh do các độc tố nấm mốc (mycotoxin), bệnh kí sinh trùng đường máu ở gà…. Do đặc điểm giống nhau về lứa tuổi và bệnh tích ở cơ quan có thẩm quyền miễn dịch, cần chẩn đoán phân biệt giữa bệnh Gumboro và bệnh thiếu máu truyền nhiễm. Cụ thể: gà dưới 13 tuần tuổi khi mắc Gumboro và bệnh thiếu máu truyền nhiễm đều có biểu hiện ủ rũ khá giống nhau (Wang & cs, 2011; Gowthaman, 2019). Tuy nhiên, bệnh thiếu máu truyền nhiễm thường có các biểu hiện bên ngoài như xuất huyết ở da cánh (bệnh cánh xanh). Bệnh tích mổ khám có nhiều điểm chung, ví dụ như hiện tượng teo túi Fabricius. Tuy nhiên, bệnh tích sưng và xuất huyết túi Fabricius chỉ gặp ở bệnh Gumboro (Wang & cs, 2011) mà không có ở bệnh thiếu máu truyền nhiễm. Một số bệnh tích điển hình chỉ gặp trong bệnh thiếu máu truyền nhiễm, ví dụ như tủy xương nhạt màu.
Với bệnh kí sinh trùng đường máu, thường xảy ra vào mùa nóng từ tháng 3 đến tháng 8 hàng năm ở gà 35 ngày tuổi trở lên. Triệu chứng: gà sốt cao, mệt mỏi, mào nhợt nhạt, bị mất thăng bằng, tiêu chảy phân màu xanh lá cây, máu loãng khó đông hoặc không đông. Bệnh tích đặc trưng: xuất huyết các cơ quan như gan, tụy, thận, buồng trứng; do kí sinh trùng di chuyển nên còn gây hiện tượng gan, thận, lách sưng to, biến dạng, mủn nát và dễ vỡ. Tuy nhiên, để chẩn đoán khẳng định thì vẫn cần phải lấy mẫu để xét nghiệm trong phòng thí nghiệm, tìm thấy leukocytozoon trong tiêu bản máu hoặc schizont (liệt thể) trong gan, lách, não gà bệnh.
1.1.8. Phòng bệnh
1.1.8.1. Vệ sinh phòng bệnh
Công tác chăm sóc, quản lý tốt đàn giống và vệ sinh phòng bệnh, tăng cường biện pháp đảm bảo an toàn sinh học là những biện pháp tổng hợp giúp ngăn chặn bệnh xảy ra.
1.1.8.2. Phòng bệnh bằng vacxin
Do (i) kháng thể đặc hiệu truyền qua lòng đỏ có khả năng bảo hộ gà con và do (ii) gà mắc bệnh thiếu máu truyền nhiễm thể lâm sàng thường ở giai đoạn < 3 tuần tuổi, nên vacxin phòng bệnh thiếu máu truyền nhiễm chủ yếu dùng cho đàn gà bố mẹ nhằm tạo miễn dịch thụ động. Sử dụng vacxin cho đàn bố mẹ trước khi vào giai đoạn khai thác trứng khoảng vài tuần còn có thể ngăn ngừa sự truyền dọc mầm bệnh qua trứng. Vacxin được sử dụng vào thời điểm 13 – 15 tuần tuổi, không được muộn quá 3 tuần trước khi gà bắt đầu đẻ bói để tạo đáp ứng miễn dịch ở ngưỡng cao (hiệu giá trung hòa > 8 log2) giúp ngăn chặn sự truyền virus qua trứng (Vielitz & cs, 1987; Mcnulty, 1991). Vacxin nhược độc được sử dụng bằng cách cho uống, vacxin vô hoạt được sử dụng theo đường tiêm.
Tại Việt Nam hiện đang lưu hành vacxin phòng bệnh cho đàn gà gồm:
– Nobilis CAV P4 (hãng Intervet, Hà Lan): vacxin nhược độc đông khô, mỗi liều có ít nhất 2,3 log10 TCID50 virus vacxin CIAV được nuôi cấy trên phôi gà. Vacxin dùng để tiêm cho gà khỏe mạnh từ 6 tuần trở lên. Gà đẻ được phòng ít nhất 6 tuần trước khi bắt đầu đẻ. Nên tiêm vacxin cho tất cả những con gà dễ mắc bệnh trong trang trại cùng một lúc. Trong mọi trường hợp, không được dùng vacxin cho gà nhỏ hơn 6 tuần tuổi. Virus vacxin mặc dù không có khả năng gây bệnh thể lâm sàng, vẫn có thể tồn tại lâu dài trong tuyến ức, lách và tạo đáp ứng miễn dịch dịch thể ở mức thấp (Vaziry & cs, 2011).
– AviPro Thymovac (Lohmann Animal Health GmbH): vacxin nhược độc đông khô chủng Cux-1 phòng bệnh thiếu máu truyền nhiễm gà. Vacxin được dùng bằng cách pha nước uống cho gà từ 12-14 tuần tuổi nhưng không được muộn hơn 6 tuần trước khi đẻ (nếu dùng trong giai đoạn 6 tuần trước khi đẻ virus có thể truyền qua trứng).
1.1.9. Biện pháp can thiệp
Vì bệnh do virus gây ra nên không có thuốc điều trị đặc hiệu. Xu hướng hiện nay trên thế giới là phát triển các sản phẩm nguồn gốc thảo dược để cải thiện một số biểu hiện (hiện tượng suy giảm miễn dịch, thiếu máu cũng như giảm sinh trưởng) do ảnh hưởng của CIAV.
TÀI LIỆU THAM KHẢO
- Adair B. (2000). Immunopathogenesis of chicken anemia virus infection, Developmental Comparative Immunology, 24(2-3): 247-255.
- Balamurugan V. & Kataria, J. M. (2006). Economically important non-oncogenic immunosuppressive viral diseases of chicken- current status, Vet Res Commun, 30(5): 541-66.
- Cardona C. J., Oswald, W. B. & Schat, K. (2000). Distribution of chicken anaemia virus in the reproductive tissues of specific-pathogen-free chickens, Journal of General Virology, 81(8): 2067-2075.
- Chandratilleke D., O’connell, P. & Schat, K. A. (1991). Characterization of proteins of chicken infectious anemia virus with monoclonal antibodies, Avian Dis, 35(4): 854-62.
- Davidson I., Kedem, M., Borochovitz, H., Kass, N., Ayali, G., Hamzani, E., Perelman, B., Smith, B. & Perk, S. (2004). Chicken infectious anemia virus infection in Israeli commercial flocks: virus amplification, clinical signs, performance, and antibody status, Avian diseases, 48(1): 108-118.
- De Boer G. F., Van Roozelaar, D. J., Moormann, R. J., Jeurissen, S. H., Wijngaard, J. C., Hilbink, F. & Koch, G. (1994). Interaction between chicken anaemia virus and live Newcastle disease vaccine, Avian Pathol, 23(2): 263-75.
- Dhama K., Mahendran, M., Somvanshi, R. & Chawak, M. (2008). Chicken infectious anaemia virus: an immunosuppressive pathogen of poultry- a review, Indian J. Vet. Pathol, 32(2): 158-167.
- Fang L., Li, Y., Wang, Y., Fu, J., Cui, S., Li, X., Chang, S. & Zhao, P. (2017). Genetic analysis of two chicken infectious anemia virus variants-related Gyrovirus in stray mice and dogs: the first report in China, 2015, BioMed research international, 2017(2017): 1-9.
- Gelderblom H., Kling, S., Lurz, R., Tischer, I. & Bülow, V. V. (1989). Morphological characterization of chicken anaemia agent (CAA), Archives of virology, 109(1-2): 115-120.
- Goryo M., Suwa, T., Matsumoto, S., Umemura, T. & Itakura, C. (1987). Serial propagation and purification of chicken anaemia agent in MDCC-MSB1 cell line, Avian Pathol, 16(1): 149-63.
- Gowthaman V. (2019). Chicken infectious anaemia virus. In: Recent Advances in Animal Virology. Malik, Y. S., Singh, R. K. and Yadav, M. P. (eds.). Springer Singapore Singapore: 197-205
- Hagood L. T., Kelly, T. F., Wright, J. C. & Hoerr, F. J. (2000). Evaluation of chicken infectious anemia virus and associated risk factors with disease and production losses in broilers, Avian Dis, 44(4): 803-8.
- Hailemariam Z., Omar, A. R., Hair-Bejo, M. & Giap, T. C. (2008). Detection and characterization of chicken anemia virus from commercial broiler breeder chickens, Virol J, 5:
- Imai K., Mase, M., Tsukamoto, K., Hihara, H. & Yuasa, N. (1999). Persistent infection with chicken anaemia virus and some effects of highly virulent infectious bursal disease virus infection on its persistency, Research in Veterinary Science, 67(3): 233-238.
- Jeurissen S. H., Wagenaar, F., Pol, J. M., Van Der Eb, A. J. & Noteborn, M. H. (1992). Chicken anemia virus causes apoptosis of thymocytes after in vivo infection and of cell lines after in vitro infection, J Virol, 66(12): 7383-8.
- Kaffashi A., Noormohammadi, A. H., Allott, M. L. & Browning, G. F. (2006). Viral load in 1-day-old and 6-week-old chickens infected with chicken anaemia virus by the intraocular route, Avian Pathol, 35(6): 471-4.
- Kye S. J., Kim, J. Y., Seul, H. J., Kim, S., Kim, S. E., Lee, H. S., Sorn, S. & Choi, K. S. (2013). Phylogenetic analysis and genetic characterization of chicken anemia virus isolates from Cambodia, Poult Sci, 92(10): 2681-6.
- Lucio B., Schat, K. & Shivaprasad, H. (1990). Identification of the chicken anemia agent, reproduction of the disease, and serological survey in the United States, Avian diseases, 34(1): 146-153.
- Mcilroy S., Mcnulty, M., Bruce, D., Smyth, J., Goodall, E. & Alcorn, M. (1992). Economic effects of clinical chicken anemia agent infection on profitable broiler production, Avian diseases, 36(3): 566-574.
- Mcneilly F., Smyth, J., Adair, B. & Mcnulty, M. (1995). Synergism between chicken anemia virus (CAV) and avian reovirus following dual infection of 1-day-old chicks by a natural route, Avian diseases, 39(3): 532-537.
- Mcnulty M. S. (1991). Chicken anaemia agent: a review, Avian Pathology, 20(2): 187-203.
- Mcnulty M. S., Connor, T. J., Mcneilly, F., Mcloughlin, M. F. & Kirkpatrick, K. S. (1990). Preliminary characterisation of isolates of chicken anaemia agent from the United Kingdom, Avian Pathol, 19(1): 67-73.
- Meehan B. M., Todd, D., Creelan, J. L., Earle, J. A., Hoey, E. M. & Mcnulty, M. S. (1992). Characterization of viral DNAs from cells infected with chicken anaemia agent: sequence analysis of the cloned replicative form and transfection capabilities of cloned genome fragments, Arch Virol, 124(3-4): 301-19.
- Miles A. M., Anderson, A. S., Bernberg, E. L., Kent, J., Rosenberger, J. K., Pope, C. R. & Morgan, R. W. (1999). Comparison of two serotype 1 MDV isolates, Acta Virol, 43(2-3): 102-5.
- Natesan S., Kataria, J. M., Dhama, K., Rahul, S. & Bhardwaj, N. (2006). Biological and molecular characterization of chicken anaemia virus isolates of Indian origin, Virus Res, 118(1-2): 78-86.
- Niu J. T., Yi, S. S., Dong, G. Y., Guo, Y. B., Zhao, Y. L., Huang, H. L., Wang, K., Hu, G. X. & Dong, H. (2019). Genomic characterization of diverse gyroviruses identified in the feces of domestic cats, Sci Rep, 9(1):
- Noteborn M., Verschueren, C., Koch, G. & Van Der Eb, A. J. (1998). Simultaneous expression of recombinant baculovirus-encoded chicken anaemia virus (CAV) proteins VP1 and VP2 is required for formation of the CAV-specific neutralizing epitope, Journal of General Virology, 79(12): 3073-3077.
- Noteborn M. H., De Boer, G. F., Van Roozelaar, D. J., Karreman, C., Kranenburg, O., Vos, J. G., Jeurissen, S. H., Hoeben, R. C., Zantema, A., Koch, G. & Et Al. (1991). Characterization of cloned chicken anemia virus DNA that contains all elements for the infectious replication cycle, J Virol, 65(6): 3131-9.
- Noteborn M. H., Todd, D., Verschueren, C. A., De Gauw, H. W., Curran, W. L., Veldkamp, S., Douglas, A. J., Mcnulty, M. S., Van Der, E. A. & Koch, G. (1994). A single chicken anemia virus protein induces apoptosis, J Virol, 68(1): 346-51.
- Peters M. A., Jackson, D. C., Crabb, B. S. & Browning, G. F. (2002). Chicken anemia virus VP2 is a novel dual specificity protein phosphatase, J Biol Chem, 277(42): 39566-73.
- Renshaw R. W., Soiné, C., Weinkle, T., O’connell, P. H., Ohashi, K., Watson, S., Lucio, B., Harrington, S. & Schat, K. A. (1996). A hypervariable region in VP1 of chicken infectious anemia virus mediates rate of spread and cell tropism in tissue culture, Journal of virology, 70(12): 8872-8878.
- Rosario K., Breitbart, M., Harrach, B., Segalés, J., Delwart, E., Biagini, P. & Varsani, A. (2017). Revisiting the taxonomy of the family Circoviridae: establishment of the genus Cyclovirus and removal of the genus Gyrovirus, Archives of virology, 162(5): 1447-1463.
- Rosenberger J. K. & Cloud, S. S. (1989). The effects of age, route of exposure, and coinfection with infectious bursal disease virus on the pathogenicity and transmissibility of chicken anemia agent (CAA), Avian Dis, 33(4): 753-9.
- Spackman E., Cloud, S. S. & Rosenberger, J. K. (2002). Comparison of a putative second serotype of chicken infectious anemia virus with a prototypical isolate II. Antigenic and physicochemical characteristics, Avian Dis, 46(4): 956-
- Toro H., Ewald, S. & Hoerr, F. J. (2006). Serological evidence of chicken infectious anemia virus in the United States at least since 1959, Avian Dis, 50(1): 124-6.
- Toro H., Gonzalez, O., Escobar, C., Cerda, L., Morales, M. A. & Gonzalez, C. (2001). Vertical induction of the inclusion body hepatitis/hydropericardium syndrome with fowl adenovirus and chicken anemia virus, Avian Dis, 45(1): 215-
- Trinh D. Q., Ogawa, H., Bui, V. N., Baatartsogt, T., Kizito, M. K., Yamaguchi, S. & Imai, K. (2015a). Characterization of mAbs to chicken anemia virus and epitope mapping on its viral protein, VP1, J Gen Virol, 96(Pt 5): 1086-1097.
- Trinh D. Q., Ogawa, H., Bui, V. N., Nguyen, T. T. H., Gronsang, D., Baatartsogt, T., Kizito, M. K., Aboelkhair, M., Yamaguchi, S., Nguyen, V. K. & Imai, K. (2015b). Development of a blocking latex agglutination test for the detection of antibodies to chicken anemia virus, Journal of Virological Methods, 221: 74-80.
- Truchado D. A., Diaz-Piqueras, J. M., Gomez-Lucia, E., Domenech, A., Mila, B., Perez-Tris, J., Schmidt-Chanasit, J., Cadar, D. & Benitez, L. (2019). A novel and divergent Gyrovirus with unusual genomic features detected in wild passerine birds from a remote rainforest in French Guiana, Viruses, 11(12).
- Urlings H. A., De Boer, G. F., Van Roozelaar, D. J. & Koch, G. (1993). Inactivation of chicken anaemia virus in chickens by heating and fermentation, Vet Q, 15(3): 85-8.
- Van Santen V. L., Li, L., Hoerr, F. J. & Lauerman, L. H. (2001). Genetic characterization of chicken anemia virus from commercial broiler chickens in Alabama, Avian Dis, 45(2): 373-88.
- Vaziry A., Silim, A., Bleau, C., Frenette, D. & Lamontagne, L. (2011). Chicken infectious anaemia vaccinal strain persists in the spleen and thymus of young chicks and induces thymic lymphoid cell disorders, Avian pathology, 40(4): 377-
- Vielitz E., Von Bulow, V., Landgraf, H. & Conrad, C. (1987). Anemia in broilers-development of a vaccine for breeder stock, Zentralbl Veterinarmed B, 34(8): 553-7.
- Wanasawaeng W., Buatong, J., Chaichote, S. & Chansiripornchai, N. (2013). Molecular Characterization of chicken infectious anemia virus outbreaks during 2008-2011 in Thailand, The Thai Journal of Veterinary Medicine, 43(4): 497-502.
- Wang A., Liu, F., Wang, Z., Jiang, X., Wang, W., Teng, K. & Xu, J. (2011). Pathological study of SPF chickens experimentally infected with a Chinese IBDV strain BC6/85, Asian Journal of Animal and Veterinary Advances, 6: 36-50.
- Wani M. Y., Dhama, K., Latheef, S. K., Barathidassan, R., Tiwari, R., Chakraborty, S., Chawak, M. M. & Singh, S. D. (2014). Experimental pathological studies of an Indian chicken anaemia virus isolate and its detection by PCR and FAT, Pak J Biol Sci, 17(6): 802-811.
- Yuasa N. (1983). Propagation and infectivity titration of the Gifu-1 strain of chicken anemia agent in a cell line (MDCC-MSB1) derived from Marek’s disease lymphoma, National Institute of Animal Health Quarterly, 23(1): 13-20.
- Yuasa N. (1992). Effect of chemicals on the infectivity of chicken anaemia virus, Avian Pathology, 21(2): 315-319.
- Yuasa N. & Imai, K. (1986). Pathogenicity and antigenicity of eleven isolates of chicken anaemia agent (CAA), Avian Pathol, 15(4): 639-45.
- Yuasa N., Imai, K. & Nakamura, K. (1988). Pathogenicity of chicken anaemia agent in bursectomised chickens, Avian Pathol, 17(2): 363-9.
- Yuasa N., Taniguchi, T. & Yoshida, I. (1979). Isolation and some characteristics of an agent inducing anemia in chicks, Avian diseases: 366-385.
- Yuasa N. & Yoshida, I. (1983). Experimental egg transmission of chicken anemia agent, National Institute of Animal Health Quarterly, 23(3): 99-100.
- Zhang X., Xie, Q., Ji, J., Chang, S., Liu, J., Chen, F., Ma, J. & Bee, Y. (2012). Complete genome sequence analysis of a recent chicken anemia virus isolate and comparison with a chicken anemia virus isolate from human fecal samples in China, J Virol, 86(19): 10896-7.


 English
English