PRESENCE OF CHLOROGENIC ACID DURING IN VITRO MATURATION PROTECTS PORCINE OOCYTES FROM THE NEGATIVE EFFECT OF HEAT STRESS
Nguyễn Văn Thành1, Đỗ Thị Kim Lành1, Tamas Somfai2, Takeshige Otoi3, Masayasu Taniguchi4, Kazuhiro Kikuchi4,5
1Bộ môn Ngoại – Sản, Khoa Thú y, Học viện Nông nghiệp Việt Nam
2Phòng Nghiên cứu Chăn nuôi và Sinh sản, Viện Khoa học Chăn nuôi và Đồng cỏ (NILGS), Tổ chức Nghiên cứu Nông nghiệp và Thực phẩm Quốc gia (NARO), Tsukuba, Nhật Bản
3 Khoa Sinh học và Công nghiệp Sinh học, Đại học Tokushima, Tokushima, Nhật Bản
4Trường Cao học Khoa học Thú y, Đại học Yamaguchi, Yamaguchi, Nhật Bản
5Phòng Khoa học Động vật, Viện Khoa học Nông nghiệp (NIAS), Tổ chức Nghiên cứu Nông nghiệp và Thực phẩm Quốc gia (NARO), Tsukuba, Nhật Bản
Tính cấp thiết
Stress nhiệt là một vấn đề quan trọng trong ngành chăn nuôi lợn vì nó làm suy giảm đáng kể năng suất sinh sản của lợn nái và do đó gây ra hậu quả thiệt hại về kinh tế. Stress nhiệt ảnh hưởng đến khả năng sinh sản của con cái vì sự phát triển của giao tử và phôi bị suy giảm dưới nhiệt độ môi trường cao, dẫn đến suy giảm sự phát triển của nang trứng, sự trưởng thành của noãn bào, sự phát triển của phôi và sự phát triển của thai. Ngoài ra, đã có nghiên cứu cho thấy stress nhiệt có tác động bất lợi đối với khả năng giảm phân và phát triển khi buồng trứng hoặc tế bào trứng của. Stress nhiệt trong quá trình trưởng thành của tế bào trứng kích hoạt con đường chết theo chương trình, được trung gian bởi caspase nhóm II. Hơn nữa, stress nhiệt làm tăng stress oxy hóa trong các tế bào thông qua sự tích tụ của các loại oxy phản ứng (ROS), là nhân tố chính gây ra sự thất bại trong quá trình phát triển phôi. Nồng độ ROS quá cao sẽ gây rối loạn chức năng tế bào thông qua tương tác với lipid, protein và axit nucleic, gây mất tính toàn vẹn của màng, thay đổi cấu trúc và chức năng đối với protein và làm hỏng axit nucleic.
Bổ sung chất chống oxy hóa có thể ngăn ngừa hoặc giảm tích lũy ROS nội bào và cải thiện năng lực phát triển của phôi. Axit chlorogen (CGA) là một hợp chất phenolic được tìm thấy chủ yếu trong cà phê và trà, cũng như trong nhiều loại trái cây và rau quả. Trước đây, người ta đã chứng minh rằng CGA có hoạt tính loại bỏ ROS, chống oxy hóa và chống chết tế bào chết theo chương trình. Trên cơ sở này, chúng tôi đã đưa ra giả thuyết rằng CGA có thể làm giảm bớt tác động của stress nhiệt đối với tế bào trứng của lợn.
Mục đích nghiên cứu:
Nghiên cứu này nhằm xác định ảnh hưởng của việc bổ sung CGA trong quá trình trưởng thành tế bào trứng trong ống nghiệm (IVM) của lợn ở cả hai điều kiện siêu nhiệt (41,0°C) và đẳng nhiệt (38,5°C), tập trung vào sự trưởng thành của nhân, tình trạng tự chết theo chương trình và năng lực phát triển của phôi sau khi kích hoạt parthenogenetic.
Phương pháp nghiên cứu:
3.1. Thu và nuôi thành thục tế bào trứng lợn trong ống nghiệm (IVM)
Buồng trứng lợn được lấy từ lợn hậu bị lai trước tuổi dậy thì (giống Landrace × Yorkshire) tại lò mổ địa phương, được bảo quản trong nước muối sinh lý (NaCl 0,9% (w/ v)) ở 30°C và vận chuyển đến phòng thí nghiệm trong vòng 1 giờ. Buồng trứng được rửa ba lần bằng dung dịch m- PBSbổ sung 100 IU/mL penicillin G và 0,1 mg/ml streptomycin sulphate. Phức hợp Cumulus-noãn bào (COC) được thu thập bằng cách cắt các nang có đường kính 2–6 mm trong Môi trường 199 có chứa muối được bổ sung 20 mM HEPES.. Môi trường cơ bản cho IVM được xác định trước đây là môi trường tế bào trứng lợn (POM) được bổ sung 3 mg/ml rượu polyvinyl và 10 ng/ml eGF. Trong 22 giờ đầu tiên của IVM, 10 IU/mL eCG; 10 IU/mL hCG và 1,0 mmol/L dbcAMP đã được thêm vào môi trường IVM (POM 1). Vào 22 giờ của IVM, các nhóm tế bào trứng được rửa ba lần trong cùng một môi trường không có hormone và dbcAMP (POM 2) và được nuôi cấy trong POM 2 trong 22–24 giờ IVM bổ sung. Khoảng 50 COC được nuôi cấy trong 500 μL môi trường trưởng thành trong dầu khoáng trong các đĩa nuôi cấy 4 giếng (SPL). Tất cả các quá trình ủ được thực hiện trong tủ ấm có độ ẩm chứa 5% CO2 ,5%O2, và 90% N2 trong không khí ở 38,5°C.
3.2. Phân tích sự trưởng thành của tế bào trứng và tình trạng apoptosis
Để đánh giá tốc độ trưởng thành và chết theo chương trình của tế bào trứng, các tế bào trứng được phân tích sau IVM bằng cách sử dụng kỹ thuật kết hợp để nhuộm đồng thời hoặc nhân và nhuộm TUNEL được sửa đổi từ các quy trình được mô tả trước đây (Do et al., 2015). Tóm lại, các tế bào trứng được giải phóng khỏi các tế bào tích bằng cách tiếp xúc với 150 IU hyaluronidase và pipet cơ học. Các tế bào trứng bị loại bỏ được cố định qua đêm ở 4°C trong 3,7% (w/v) paraformaldehyde được pha loãng trong PBS. Sau khi cố định, chúng được thấm trong PBS chứa 0,1% (v/v) Triton‐X100 trong 40 phút, sau đó ủ qua đêm ở 4°C trong PBS chứa 10 mg/ml albumin huyết thanh bò (BSA; dung dịch chặn). Sau đó, chúng được ủ trong thuốc thử 2-deoxyuridine 5-triphosphate và TUNEL kết hợp với fluorescein trong 1 giờ ở 38,5°C. Sau đó, các tế bào trứng được đặt trên các phiến kính và được nhuộm ngược với 1,9 mM bisbenzimide trước khi được phủ lên bằng các tấm phủ và sơn móng tay trong suốt. Các tế bào trứng được dán nhãn đã được kiểm tra bằng kính hiển vi phát quang dưới các bước sóng kích thích 550nm và 350nm để hình dung màu TUNEL và Hoechst tương ứng. Bất kỳ noãn bào nào có nhân đánh dấu TUNEL màu xanh lá cây đều được phân loại là apoptotic (Hình 1).
3.3. Kích thích đơn tính của tế bào trứng IVM
Sự kích thích đơn tính của tế bào trứng IVM được tiến hành theo mô tả của Iwamoto et al. (2005). Tóm lại, các tế bào trứng đã tách màng được chuyển sang dung dịch kích hoạt bao gồm 0,28 MD-mannitol, 0,05 mM CaCl2, 0,1 mM MgSO4, và 0,01% (w/v) BSA và ounce đã rửa. Các tế bào trứng sau đó được kích thích bằng xung dòng điện một chiều 1,5 kV/cm trong khoảng thời gian 100 μs bằng cách sử dụng bộ lai soma được kết nối với đơn vị dung hợp tế bào LF101 (BEX).
3.4. Nuôi cấy phôi và đánh giá chất lượng phôi nang
Sau khi kích thích điện, các tế bào trứng được rửa bằng môi trường PZM3 và nuôi cấy trong 50-µl giọt PZM3 phủ dầu khoáng trong đĩa petri 35 mm để 7 ngày. Vào ngày thứ 2 (Ngày 0 = ngày kích thích), các đĩa nuôi cấy được bổ sung 10% (v/v) FBS. Sự phân tách và sự hình thành phôi nang lần lượt được đánh giá dưới kính hiển vi soi nổi vào Ngày thứ 2 và Ngày thứ 7.
Để đánh giá tổng số tế bào trên mỗi phôi nang, phôi vào Ngày thứ 7 đã được cố định và thấm vào PBS của Dulbecco được bổ sung 3,7% (w/v) paraformaldehyde và 1% (v/v) Triton X-100 ở nhiệt độ phòng trong 15 phút. Sau đó, phôi được đặt trên các phiến kính, được nhuộm bằng 1,9 mM Hoechst 33342 được pha loãng trong glycerol và được gắn dưới nắp đậy. Các phiến kính được giữ ở 4–8°C qua đêm và sau đó phôi được kiểm tra bằng kính hiển vi huỳnh quang (Hình 2). Trong nghiên cứu này, bất kỳ phôi nào có túi phôi rõ ràng và bao gồm hơn 16 tế bào đều được xác định là phôi nang.
Kết quả chính:
Đối với sự trưởng thành trong ống nghiệm (IVM) ở 41,0°C (điều kiện nhiệt độ cao), việc bổ sung 50 μM CGA vào môi trường trưởng thành đã cải thiện đáng kể tỷ lệ tế bào trứng trưởng thành và giảm tỷ lệ chết theo chương trình so với tế bào trứng trưởng thành không có CGA (P< .05). Xử lý tế bào trứng bằng CGA trong IVM dưới điều kiện tăng thân nhiệt có xu hướng tăng (P< .1) phần trăm hình thành túi phôi sau quá trình sinh sản đơn tính và tăng lên đáng kể (P< .05) tổng số tế bào trên mỗi phôi nang so với tế bào trứng trưởng thành không có CGA. Đối với IVM ở 38,5°C (điều kiện đẳng nhiệt), CGA đã cải thiện đáng kể tốc độ phát triển phôi nang so với tế bào trứng trưởng thành mà không có CGA (P< .05), nhưng không ảnh hưởng đến sự trưởng thành của tế bào trứng, tỷ lệ chết theo chương trình hoặc số lượng tế bào trên mỗi phôi. Việc loại bỏ tất cả các chất chống oxy hóa khỏi môi trường IVM làm giảm đáng kể tốc độ trưởng thành của tế bào trứng, nhưng tốc độ này đã được phục hồi khi bổ sung CGA.
Kết luận:
Những kết quả này chứng minh rằng CGA là một chất chống oxy hóa mạnh giúp bảo vệ tế bào trứng của lợn khỏi những tác động tiêu cực của stress nhiệt, do đó làm giảm tần suất chết theo chương trình và cải thiện chất lượng phôi.
Từ khóa: chlorogenic acid, embryo development, heat stress, parthenogenesis, porcine oocyte
Link bài báo: https://onlinelibrary.wiley.com/doi/10.1111/asj.13302
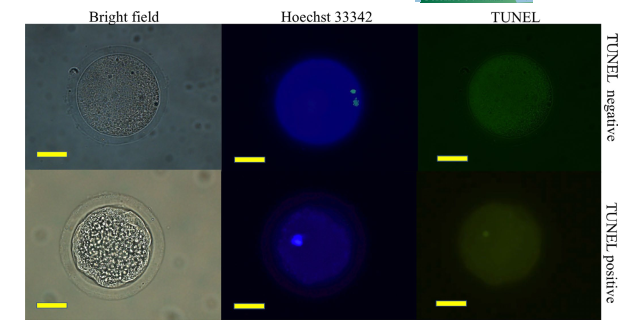
Hình 1: Hình ảnh đại diện của tế bào trứng lợn tiếp xúc với trường sáng, Hoechst 33342 và TUNEL. Màu xanh lam và xanh lục tương ứng là hạt nhân thông thường và hạt nhân apoptotic. Thanh tỷ lệ = 50 m
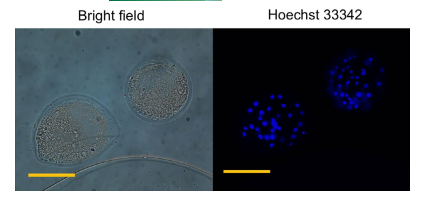
Hình 2: Hình ảnh đại diện của phôi nang lợn tiếp xúc với trường sáng và Hoechst. Số lượng tế bào trong mỗi phôi nang được tính bằng số lượng nhân có nhãn màu xanh với Hoechst 33342. Thanh tỷ lệ = 100 μm
Bảng 1: Ảnh hưởng của việc bổ sung axit chlorogenic (CGA) trong quá trình trưởng thành in vitro đối với tình trạng tế bào trứng của lợn trong điều kiện đẳng nhiệt và siêu nhiệt*
| Nhiệt độ tiếp xúc (°C) | Môi trường | Số tế bào trứng được kiểm tra | Số (%) tế bào trứng trưởng thành | Số lượng (%) tế bào trứng ap-optotic** |
| 38,5 (đẳng nhiệt) | POM + CGA 50 µM | 226 | 189 (83,6 ± 1,6)a | 0a |
| POM không có CGA | 209 | 168 (80,4 ± 2,9)a | 0a | |
| 41,0 (tăng thân nhiệt) | POM + CGA 50 µM | 162 | 129 (79,6 ± 1,9)a | 14 (8,6 ± 3,0)b |
| POM không có CGA | 231 | 160 (69,3 ± 2,1)b | 43 (18,6 ± 4,4)c |
* Sáu thử nghiệm lặp lại đã được thực hiện. Dữ liệu được thể hiện dưới dạng trung bình ±SEM.
- * Chỉ số chết theo chương trình được định nghĩa là tỷ lệ giữa số tế bào trứng có nhân theo chương trình trên tổng số tế bào trứng được kiểm tra.
- a, b, c Các giá trị có các chỉ số trên khác nhau trong cùng một cột thì khác nhau đáng kể (P< .05).
Bảng 2: Ảnh hưởng của việc bổ sung CGA trong quá trình trưởng thành in vitro của tế bào trứng lợn trong điều kiện đẳng nhiệt và siêu nhiệt đối với sự phát triển tiếp theo của chúng sau khi kích hoạt parthenogenetic
| Nhiệt độ tiếp xúc (°C) | Môi trường | Số phôi được kiểm tra | Số (%) của phôi bị cắt | Số lượng (%) phát triển đến giai đoạn túi phôi | Tổng số tế bào trên mỗi phôi nang |
| 38,5 (đẳng nhiệt) | POM + CGA 50 µM | 262 | 185 (70,6 ± 5,2) | 45 (17,2 ± 2,9)a | 52±2,2a |
| POM không có CGA | 297 | 205 (69,0 ± 4,0) | 25 (7,7 ± 2,5)b | 46,0 ± 3,2a | |
| 41,0 (tăng thân nhiệt) | POM + CGA 50 µM | 283 | 181 (64,0 ± 2,0) | 34 (12,0 ± 2,1)ab | 47,7±2,3a |
| POM không có CGA | 303 | 185 (61,1 ± 3,4) | 16 (5,3 ± 1,5)b | 32,1±3,4b |
* Sáu thử nghiệm lặp lại đã được thực hiện. Dữ liệu được thể hiện dưới dạng trung bình ±SEM.
*a, bCác giá trị có các chỉ số trên khác nhau trong cùng một cột thì khác nhau đáng kể (P< .05).


 English
English