Tính cấp thiết
Trước đây chúng tôi đã phát triển phương pháp chỉnh sửa gen bằng phương pháp điện phân (EP) protein Cas9, trong đó hệ thống CRISPR / Cas9 đã được đưa vào hợp tử thụ tinh trong ống nghiệm (IVF) của heo thông qua EP để phá vỡ gen mục tiêu. Phương pháp này cần được phát triển hơn nữa. Chính vì vậy, sự kết hợp của các phương pháp EP và vi tiêm (MI) nên được tiến hành để đánh giá ở heo.
Mục đích nghiên cứu:
Nghiên cứu này nhằm xác định sự kết hợp giữa vi tiêm (MI) và (điện phân) EP của hệ thống CRISPR / Cas9 liệu có thể làm tăng tỷ lệ đột biến gen sinh học đối với bộ gen ba ở phôi nang heo hay không. Chúng tôi đã nhắm mục tiêu gen homeobox1 của tuyến tụy và tá tràng (PDX1) bằng vi tiêm gen vào tế bào chất 1 giờ trước hoặc sau xung điện (EP) chỉnh sửa gen alpha-1,3-galactosyltransferase (GGTA1) và cytidine 32 monophosphat-N-acetylneuraminic acid hydroxylase (CMAH) ở hợp tử heo.
Phương pháp nghiên cứu:
Chúng tôi đã định hướng RNA dẫn đường (gRNA) nhắm mục tiêu PDX1, GGTA1 và CMAH gắn với protein Cas9 vào hợp tử IVF (giai đoạn một tế bào) sử dụng phương pháp EP 10 giờ sau IVF (IVF; nhóm EP) hoặc kết hợp với MI (trước 1 giờ, nhóm MI-EP, hoặc sau khi xung điện EP Nhóm EP-MI) từ đó đánh giá tốc độ hình thành phôi nang và hiệu quả của các đột biến mục tiêu trong phôi bào tạo thành.
Kết quả chính:
Kết quả của chúng tôi cho thấy tỷ lệ hình thành phôi nang giảm đáng kể ở hai nhóm trải qua MI lần lượt trước và sau EP (nhóm MI-EP và nhóm EP-MI), so với các nhóm chỉ được thực hiện EP (nhóm EP) (p = 0,0224 và p <0,0001 tương ứng) và đối chứng (p = 0,0029 và p <0,0001, tương ứng) . Không có sự khác biệt đáng kể về tổng tỷ lệ đột biến trong các phôi nang tạo thành giữa các nhóm thí nghiệm. Có một tác động tích cực duy nhất của MI khi phối hợp với EP (MI-EP) làm tăng tỷ lệ phôi nang mang đột biến hai alen ở ít nhất một gen mục tiêu cao hơn ở nhóm EP. Tuy nhiên, không có sự khác biệt về tỷ lệ phôi nang đột biến đồng hợp tử khi đánh giá trên 2 gen mục tiêu trở lên.
Kết luận:
Những kết quả này chỉ ra rằng mặc dù sự kết hợp MI và EP không cải thiện hiệu quả đột biến tổng số hoặc đột biến hai alen đối với việc knock-out bộ gen ba, nhưng thực hiện MI trước khi EP có tác dụng làm giảm tỷ lệ chết của hợp tử heo sau chỉnh sửa gen khi kết hợp MI và EP.
Từ khóa: clustered regularly interspaced short palindromic repeats/Cas9, electroporation, gene editing, microinjection, porcine zygotes.
Link bài báo: http://www.veterinaryworld.org/Vol.15/No.2.html
Bảng 1: Trình tự gRNA và đoạn mồi nhắm vào 3 gen.

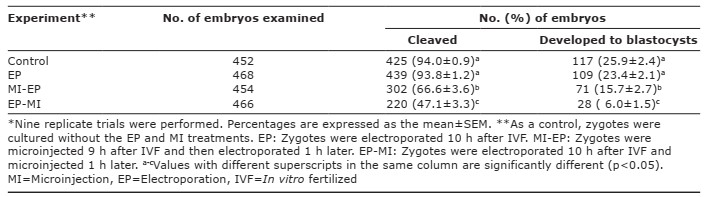
Bảng 2: Ảnh hưởng của phương pháp điện phân (EP) hoặc kết hợp với vi tiêm (MI) đến sự phát triển của hợp tử heo.
Hình 1: Giới thiệu cụm lặp lại palindromic ngắn xen kẽ nhau thường xuyên / hệ thống Cas9 nhắm mục tiêu gen homeobox1 (PDX1), gen alpha-1,3-galactosyltransferase (GGTA1), và cytidine-32-monophosphate-Nacetylneuraminic acid hydroxylase (CMAH) vào các hợp tử thụ tinh trong ống nghiệm (IVF) thông qua phương pháp điện phân (EP) hoặc kết hợp với vi tiêm (MI).
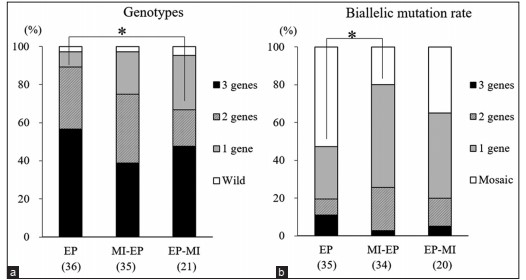
(a) Các kiểu gen của phôi nang. Tỷ lệ đại diện cho tỷ lệ phần trăm của phôi nang mang số lượng đột biến của mỗi gen mục tiêu trong tổng số phôi nang được kiểm tra. * Tỷ lệ phôi nang với đột biến ở ít nhất hai gen mục tiêu cao hơn đáng kể ở nhóm EP so với nhóm EP-MI. p <0,05.
(b) Đột biến gen ở phôi nang đã được chỉnh sửa gen. Tỷ lệ thể hiện phần trăm các đột biến hai alen trong phôi nang đã được chỉnh sửa gen. * Tỷ lệ phôi bào mang đột biến gen ở ít nhất một gen mục tiêu là đáng kể ở nhóm MI-EP cao hơn ở nhóm EP. p <0,05. EP: Ba RNA dẫn đường (gRNA) nhắm mục tiêu PDX1, GGTA1 và CMAH được đưa vào hợp tử thông qua EP lúc 10 giờ sau khi bắt đầu IVF; MI-EP: nhắm mục tiêu gRNA PDX1 đã được vi tiêm vào hợp tử 1 giờ trước EP của hai gRNA nhắm mục tiêu GGTA1 và CMAH; EP-MI: nhắm mục tiêu gRNA PDX1 đã được vi tiêm vào hợp tử 1 giờ sau EP của hai gRNA nhắm mục tiêu GGTA1 và CMAH. Các số trong ngoặc đơn trên trục X cho biết tổng số mẫu được kiểm tra.
Download bài báo: tại đâyTriple_gene_editing_in_porcine_embryos_u
Zhao Namula1,2, Quynh Anh Le1,3, Manita Wittayarat4, Qingyi Lin1,3, Koki Takebayashi1,3, Maki Hirata1,3, Lanh Thi Kim Do3,5, Fuminori Tanihara3,6 và Takeshige Otoi1,2
- Trung tâm Nghiên cứu Đổi mới Sinh học, Đại học Tokushima, 7793233 Tokushima, Nhật Bản;
- Khoa Thú y, Trường Cao đẳng Khoa học Nông nghiệp Duyên hải, Đại học Hải dương Quảng Đông, 524088 Quảng Đông, Trung Quốc;
- Phòng thí nghiệm Sinh sản Động vật, Khoa Khoa học Sinh học và Công nghiệp Sinh học, Đại học Tokushima, 7793233 Tokushima, Nhật Bản;
- Khoa Khoa học Thú y, Đại học Prince of Songkla, 90110 Songkhla, Thái Lan;
- Bộ môn Ngoại- Sản, Khoa Thú y, Học viện Nông nghiệp Việt Nam, 100000 Hà Nội, Việt Nam;
- Trung tâm Phát triển Công nghệ Y tế Tiên tiến, Đại học Y Jichi, 3290498 Tochigi, Nhật Bản.


 English
English