Trương Thị Ngọc Linh 1, Lê Thị Nguyệt 1, Nguyễn Thị Thu Hà 1, Hoàng Thanh Hảo 1
1 Khoa Thú y, Học viện Nông nghiệp Việt Nam.
Tóm tắt: Các dược liệu là hạt cau, hạt củ đậu và trầu không được chiết xuất với 6 dung môi gồm nước nóng, ethanol, methanol, ethyl acetate, acetone, hexane. Cao khô sau đó được hòa tan trở lại bằng dung dịch nước muối sinh lý tới các nồng độ: 10 mg, 5 mg và 2,5 mg/ml để thử nghiệm với ký sinh trùng thu thập được từ lòng chó nhằm đánh giá tác dụng thông qua các thông số là thời gian gây chết 50 % (LT50: lethal time 50) và 100 % (LT100: lethal time 100) động vật thí nghiệm. Kết quả cho thấy chỉ có dịch chiết hạt cau với ethanol là cho tác dụng tốt nhất trên cả giun móc, giun đũa và sán dây, theo đó khẳng định được tiềm năng ứng dụng của cây thuốc này trong việc điều trị nội ký sinh trùng trên chó.
Từ khóa: chó, hạt cau, hạt củ đậu, lá trầu không, nội ký sinh trùng.
INVESTIGATION ON IN VITRO EFFECTS OF ARECA NUTS, JICAMAI SEEDS AND PIPER BETAL LEAVES ON ENDOPARASITES OF DOGS
Abtract: Medicinal plant materials, including areca nuts, jicamai seeds and piper betal leaves were extracted with 6 solvents, including hot water, ethanol, methaol, ethyl acetate, acetone and hexane. Dried extracts were then diluted with physiological solution to obtained the concentrations of 10 mg, 5 mg and 2.5 mg/ml and tested with endoparasites collected from dog intestines. Time that induced the death of 50 % and 100 % of experimental parasites (abbreviated as lethal time 50: LT50 and lethanl time 100: LT100, respectively) were determined to evaluate the effects. Experiments showed that only extracts from areca nuts and ethanol exerted good results on all tested parasitic species, including hookworms, roundworms and tapeworms. Our investigations therefore indicate the high potentials of areca nuts as medicinal plants for endoparasitic diseases on dogs.
Từ khóa: dog, Areca nut, Jicamai seed, Piper betal leaf, endoparasite.
1. Đặt vấn đề
Kể từ sự thành công của việc tổng hợp benzimidazole vào những năm 1960, và đặc biệt là với sự ra đời của các nhóm ưu việt như ivermectin hay macrocylic lactones vào những năm 1980, việc ứng dụng các thuốc có bản chất hóa học tổng hợp trong công tác điều trị ký sinh trùng cho động vật đã nhanh chóng trở nên phổ biến và giữ một vai trò chủ chốt đối với việc khống chế nhóm bệnh này của nghành chăn nuôi thú y (Egerton et al., 1981; Miguel, 2018; Waller 2006a, b). Tuy nhiên, tính lâu dài trong chiến lược ứng dụng các thuốc hóa học trị liệu hiện gặp nhiều trở ngại, do hiện tượng kháng lại các thuốc này đã và đang được ghi nhận ngày càng nhiều trên thế giới (Miguel, 2018; Waller 2006; Kaplan and Vidyashankar, 2012; Woodgate et al., 2017). Với mầm bệnh nội ký sinh trùng, cũng đã có nhiều báo cáo liên quan đến khả năng đề kháng của mầm bệnh đối với các thuốc vốn được cho là rất hiệu quả trước đây (Hiewa, 2016). Trong bối cảnh như vậy, việc tìm kiếm các nhóm thuốc mới nhằm thay thế sự phụ thuộc vào những thuốc phổ biến hiện hành đang trở nên ngày càng cần thiết. Trong số các giải pháp được đề xuất, thì việc sử dụng những thảo dược cổ truyền được đánh giá là một hướng nghiên cứu tiềm năng (Mohey et al., 2015; Hetem, 2013). Cây thuốc đã được chứng minh là có khả năng chữa trị được nhiều loại bệnh, nhờ vào tác dụng dược lý được tạo ra bởi sự đa dạng của những thành phần hóa học có bên trong cấu trúc tế bào thực vật (Akhtar et al., 2000; Hetem, 2013; Massoud et al., 2012; Shalaby et al., 2010; Shalaby et al., 2012), Bên cạnh đó, do bản chất tự nhiên, dược liệu cũng được cho là có ít tác dụng phụ và ít tạo ra các tồn dư có hại trong sản phẩm động vật (Immanuel et al., 2004).
Các dược liệu như hạt cau, hạt củ đậu và lá trầu không đã có lịch sử lâu dài được ứng dụng cho việc điều trị nội ký sinh trùng của cả người và động vật (Bùi Thị Tho và Nguyễn Thị Thanh Hà, 2009. Đỗ Tất Lợi, 1999. Viện Dược liệu, 1999). Tuy nhiên, việc sử dụng các dược liệu này hiện chỉ chủ yếu dựa trên các kinh nghiệm dân gian và chưa có nhiều các chỉ dẫn khoa học đáng tin cậy. Điều này gây trở ngại cho việc áp dụng chúng trên phạm vi rộng, do thiếu các chỉ định cụ thể về liều lượng, hiệu quả điều trị không ổn định vì phụ thuộc nhiều vào quá trình xử lý nguyên liệu và bào chế, thường được thực hiện theo các cách thức truyền thống của người dân địa phương. Cũng đã có một số dược liệu bước đầu được các nhà nghiên cứu tại Việt Nam khảo sát trên nội ký sinh trùng, nhưng chủ yếu là cho nhóm động vật sản xuất chứ không phải cho thú cảnh. Cụ thể, các nghiên cứu đã bước đầu chứng minh dịch chiết từ vỏ cây lựu (Nguyễn Thanh Hải và cộng sự, 2014); dịch chiết từ cây sử quân tử và hạt cau (Nguyễn Văn Thanh và cộng sự, 2015) có tác dụng trên nội ký sinh trùng của lợn và gà; dịch chiết từ dược liệu ngưu tất, muồng trâu, thùn mũn, bìm bìm, keo dậu và cà dại hoa trắng có tác dụng trên sự nở và di hành của trứng và ấu trùng giun xoăn ký sinh trên dê (Nguyễn Văn Thanh và Nguyễn Thanh Hải, 2015). Tuy nhiên, chưa có các khảo sát tương tự trên nội ký sinh trùng của chó. Điều này một phần là do nội tạng của chó thường khó thu thập và có giá thành cao hơn so với nội tạng của động vật sản xuất. Thế nhưng thực tế tiềm năng ứng dụng của dược liệu trị nội ký sinh trùng trên nhóm thú cảnh, đặc biệt là trên chó cũng rất cao. Đó là do chủ nuôi của nhóm động vật này thường có xu hướng quan tâm nhiều đến độ an toàn của loại thuốc sử dụng so với những người nuôi động vật sản xuất. Vì vậy, chúng tôi thấy rằng cần có các nghiên cứu để tìm cách ứng dụng dược liệu điều trị nội ký sinh trùng cho chó, nhằm góp phần hạn chế đi sự phụ thuộc vào các thuốc hóa học trị liệu.
2. Vật liệu và phương pháp nghiên cứu
a) Dược liệu và chiết xuất
Dược liệu đã làm khô được thu mua từ công ty dược liệu An Bình (làng Nghĩa Trai, Hưng Yên). Bột dược liệu mịn (kích thước < 0,05 mm) được ngâm chiết bằng sáu dung môi có độ phân cực khác nhau, bao gồm: methanol, ethanol, aceton, ethyl acetate, hexan, nước nóng, theo tỉ lệ 1/30 (cứ 10g dược liệu khô trộn với 300 ml dung môi). Với các dung môi hữu cơ, hỗn hợp dược liệu – dung môi được trộn đều và ngâm ở nhiệt độ phòng trong 24 giờ. Với dung môi nước, dược liệu được chiết nóng bằng cách trộn bột với nước cất đun sôi và khuấy đều trong 30 phút rồi lọc khi dung môi còn nóng. Sở dĩ với nước chúng tôi không lựa chọn phương pháp ngâm thông thường là do những hoạt chất có dược tính trong cây thường kém tan trong nước lạnh, vì vậy y học truyền thống cũng thường áp dụng nhiệt độ cao cho dung môi này, ví dụ như phương pháp sắc trong nhiều giờ hay pha với nước sôi thành dạng chè, nhằm tăng khả năng hòa tan của dược chất có trong nguyên liệu vào nước. Các hỗn hợp của dược liệu với dung môi sau đó được li tâm với tốc độ 3500 vòng/ phút trong 10 phút và lọc lại qua giấy lọc. Dịch lọc tiếp tục được cô quay tại áp suất thấp nhằm loại bỏ hết dung môi và thu lấy cao dược liệu khô. Các cao này sẽ được hòa tan trở lại và pha loãng bằng dung dịch nước muối sinh lý tới các nồng độ: 10 mg, 5 mg và 2,5 mg/ml để thử nghiệm với ký sinh trùng. Sở dĩ chúng tôi lựa chọn dung dịch nước muối sinh lý để pha loãng cao dược liệu là do các thử nghiệm ban đầu cho thấy bản thân dung môi này không gây ảnh hưởng đến khả năng sống của ký sinh trùng.
b) Thử nghiệm với ký sinh trùng chó
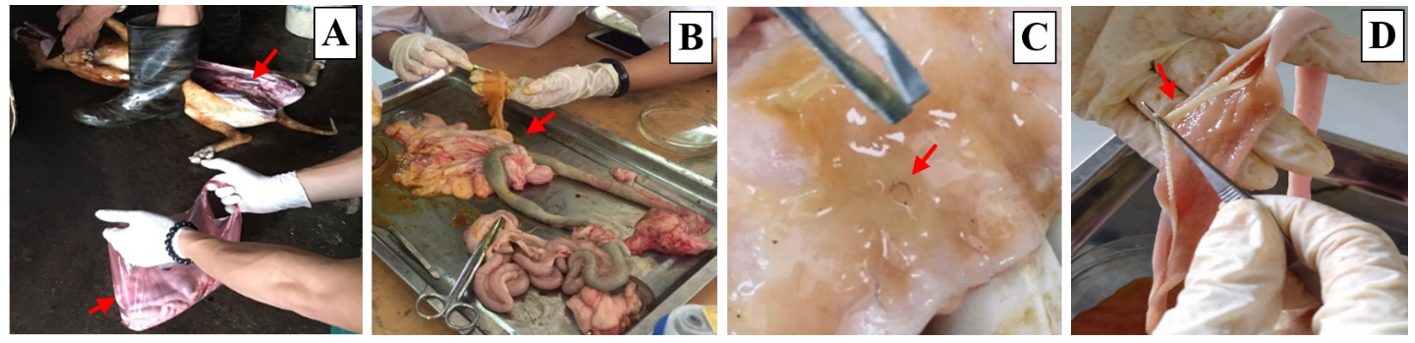
Ruột chó được thu mua từ cơ sở giết mổ Sáng-Sơn (Bắc Ninh) và mang về phòng thí nghiệm trong vòng 1 giờ (Hình 1A và 1B). Sau khi cắt bỏ phần dạ dày thì tuốt toàn bộ chất chứa bên trong ruột cho vào các đĩa lồng, quan sát để thu lấy các ký sinh trùng đã ra ngoài cùng với phần chất chứa này. Tiếp đó dùng kéo rạch mở ruột, mỗi lần rạch 1 đoạn khoảng 10-15 cm rồi dùng nhíp gắp tất cả các kí sinh trùng còn đang bám trên bề mặt ruột (Hình 1C và 1D). Kí sinh trùng sau đó được chuyển sang để ngập trong nước muối sinh lý có pH trung tính (6.9 đến 7.1) nhằm duy trì điều kiện tốt nhất trước khi thí nghiệm. Kí sinh trùng được phân loại dựa vào đặc điểm hình thái, sau đó phân chia riêng vào các đĩa lồng.
c) Thử nghiệm độc tính của dịch chiết
Do điều kiện thí nghiệm chúng tôi chỉ thử nghiệm trên chuột. Chuột được cho uống dịch chiết dược liệu khảo sát với liều 100 mg/ kgP và 1000 mg/ 1kgP, sau đó quan sát phản ứng của chuột trong 8 giờ nhằm ghi lại các dấu hiệu bất thường.
III. Kết quả và thảo luận
Chúng tôi nhận thấy chỉ có dịch chiết hạt cau là cho tác dụng tiêu diệt ký sinh trùng. Ngược lại, dịch chiết hạt củ đậu và trầu không không gây liệt hay chết ký sinh trùng trong khoảng thời gian theo dõi là 360 phút của thí nghiệm.
a) Thời gian gây chết của dịch chiết dược liệu lên ký sinh trùng
Thời gian gây chết của dịch chiết dược liệu hạt cau lên giun tròn, giun đũa và sán dây được chúng tôi thể hiện ở Bảng 1.
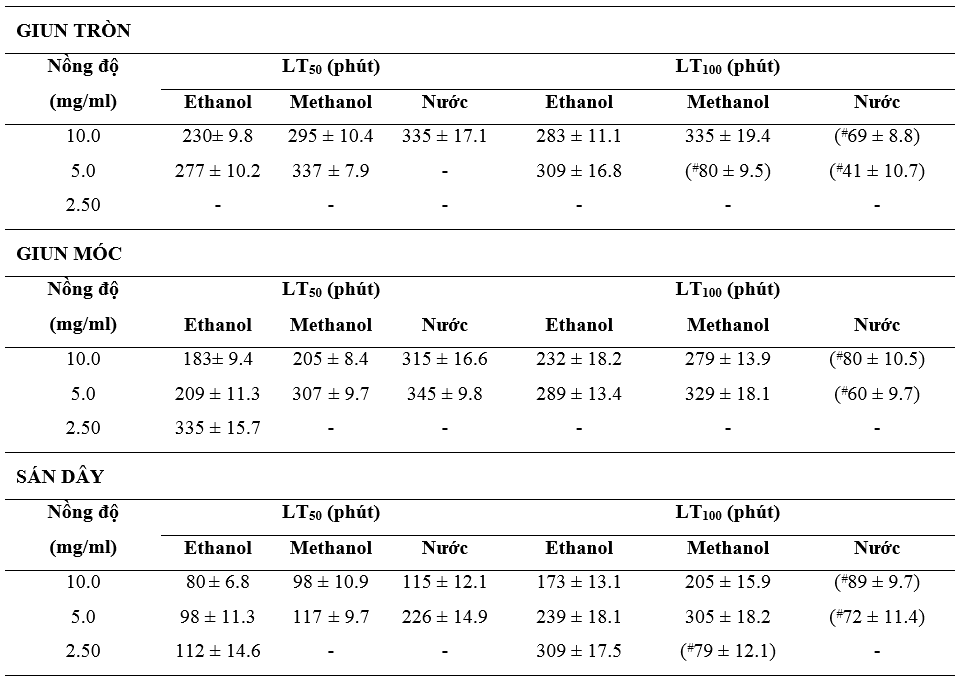
Từ kết quả thí nghiệm tại Bảng 1 chúng tôi nhận thấy dịch chiết hạt cau thể hiện tác dụng phụ thuộc nồng độ đối với cả 3 nhóm ký sinh trùng thử nghiệm. Điều này góp phần cung cấp căn cứ khoa học giải thích các ứng dụng điều trị nội ký sinh trùng của cây thuốc này trên chó trong y học cổ truyền. Bên cạnh đó, kết quả cũng tương đồng với một số nghiên cứu trước đây, trong đó khẳng định dược tính ưu việt của hạt cau so với những thảo dược truyền thống khác cũng được xếp vào nhóm trị ký sinh trùng (Nguyen et al., 2019; Yamson et al., 2019). Trong khảo sát của chúng tôi, dịch chiết dược liệu thể hiện tác dụng tốt hơn trên sán so với giun móc và giun tròn, được chứng minh bởi thời gian gây chết LT50 và LT100 ngắn hơn tại tất cả các nồng độ thử nghiệm. Điều này tương đồng với những nghiên cứu trước đây, trong đó cũng khẳng định thực vật thường cho tác dụng mạnh hơn trên sán so với giun, bao gồm cả nhóm những ký sinh trùng có vật chủ là động vật, bao gồm lợn (Hai et al., 2014; Nguyen et al., 2019) và gà (Hai et al., 2014). Tác dụng dược lý của hạt cau trên nội ký sinh trùng đã được giải thích một phần là thông qua thành phần arecoline có trong hạt cau, có tác dụng kích thích hoạt động co cơ của nội ký sinh trùng, khiến chúng bị co giật quá mức rồi sau đó bị liệt và rời ra khỏi vị trí bám (Yamson et al., 2019). Bên cạnh đó, arecoline còn có tác dụng hưng phấn thần kinh phó giao cảm của bản thân động vật chủ, kích thích nhu động ruột giúp nhanh chóng tạo ra phản ứng đẩy các ký sinh trùng này ra ngoài (Bùi Thị Tho và Nguyễn Thị Thanh Hà., 2009). Điều này lý giải tại sao các bài thuốc đông y với những dược liệu khác như vỏ lựu, hạt bí …, thầy thuốc thường yêu cầu phải sử dụng thêm các chất tẩy, nhuận tràng (VD như MgSO4) sau khi uống thuốc chính nhằm nhanh chóng loại bỏ các ký sinh trùng ra khỏi cơ thể khi chúng còn đang say thuốc, nhưng nếu là sử dụng hạt cau để trị nội ký sinh trùng thì lại không cần (Đỗ Tất Lợi, 1999).
Nghiên cứu của chủng tôi cũng ghi nhận trong các dung môi được sử dụng, ethanol là dung môi giúp thu lấy dịch chiết cho hiệu quả tốt nhất trên ký sinh trùng, thể hiện ở thời gian gây chết ngắn nhất tại tất cả các nồng độ thí nghiệm (Bảng 1). Kết quả này tương đồng với một số khảo sát trước đây, trong đó cũng khẳng định ethanol ưu việt trong việc thu lấy các thành phần có dược tính của thực vật (Nguyen et al., 2023).
b) Kết quả thử nghiệm độc tính của dịch chiết
Chuột được cho uống dịch chiết dược liệu khảo sát với liều 100 mg/ kgP và 1000 mg/ kgP, sau đó quan sát phản ứng của chuột trong 8 giờ nhằm ghi lại các dấu hiệu bất thường. Chúng thôi nhận thấy chỉ có dịch chiết hạt cau ethanol tại nồng độ 1000 mg/ kgP là khiến chuột có tình trạng run rẩy, thở gấp, xuất hiện 30 phút sau khi cho uống và biến mất sau 60 phút. Sau đó động vật không chết và cũng không xuất hiện các dấu hiệu bất thường khác. Điều này chứng minh tính an toàn của dược liệu hạt cau nếu được sử dụng với nồng độ thích hợp.
Tuy arecoline, hoạt chất được cho là có tác dụng chính trị ký sinh trùng của hạt cau được đánh giá là có tính độc, nhưng việc sử dụng nguyên liệu ở dạng trọn vẹn của đông y thường được cho là an toàn hơn so với tây khi khi tìm cách ứng dụng riêng hoạt chất chính vào lâm sàng. Điều này được giải thích là do sự có mặt đồng thời của các thành phần khác trong tế bào thực vật, đặc biệt là tanin đã phát huy vai trò làm giảm độc tích của arecolin, duy trì sự có mặt của nó tại đường tiêu hóa nhiều hơn là hấp thu vào máu và tạo ra ảnh hưởng lên hệ thần kinh của cơ thể vật chủ (Bùi Thi Tho và Nguyễn Thị Thanh Hà, 2009). Tuy nhiên, chúng tôi cho rằng cần có thêm các nghiên cứu chi tiết hơn về dược động học của arecoline khi sử dụng đơn độc và khi sử dụng dưới dạng trọn vẹn của dược liệu nhằm làm rõ và khẳng định lại ưu điểm này.
IV. Kết luận
Hạt cau có tiềm năng cao nhất để ứng dụng điều trị nội ký sinh trùng cho chó, và ethanol là dung môi ưu việt nhất để chiết xuất dược liệu này. Tuy nhiên, còn cần thêm các ứng dụng lâm sàng trên cơ thể động vật để khẳng định lại hiệu quả cũng như quan sát các độc tính trên cơ thể động vật chủ trong điều kiện in vivo.
Tài liệu tham khảo
- Akhtar MS, Iqbal Z, Khan MN, Lateef M. Anthelmintic activity of medicinal plants with particular reference to their use in animals in Indo-Pakistan subcontinent. Small Ruminant Research. 2000; 38: 99-107;
- Bùi Thị Tho và Nguyễn Thị Thanh Hà. 2009. Giáo trình Dược liệu thú y. Nhà xuất bản Đại học Nông nghiệp. Chương IV: Dược liệu có tác dụng trị ký sinh trùng.
- Đỗ Tất Lợi. 1999. Những cây thuốc và vị thuốc Việt Nam. Nhà xuất Bản Y học.
- Egerton JR, Eary CH, Suhayda D. 1981. The anthelmintic efficacy of ivermectin in experimentally infected cattle. Vet Parasitol 8, 59-70.
- Hai NT, Thanh NV, Tho BT, Atsushi M. A study about anthelmintic effect of Punica gramatum L bark on veterinary endoparasites. Asian J Pharm Clin Res 2014;7:148-52.
- Hetem A. S. Anthelmintics Resistance; How to overcome it? Iranian J Parasitol. 2013. 8(1): 18-31
- Hiewa OD. Veterinary Anthelmintics and Anthelmintic drug resistance. Journal of Zankoy Sulaimani. 2016. Part A: 191-206.
- Immanuel G, Vincybai VC, Sivaram V, Palavesam A, Marian MP. Effect of butanolic extracts from terrestrial herbs and seaweeds on the survival, growth and pathogen (Vibrio parahaemolyticus) load on shrimp Penaeus indicus juveniles. Aquaculture 2004;236:53-65
- Kaplan R, Vidyashankar A. 2012. An inconvenient truth: global worming and anthelmintic resistance. Vet Parasitol 186, 70-78.
- Massoud AM, Shalaby HA, El Khateeb RM, Mahmoud MS, Kutkat MA. Effects of Mirazid and myrrh volatile oil on adult Fasciola gigantic under laboratory conditions. Asian Pacific J Trop Biomed. 2012; 2: 875.
- Miguel Peña-Espinoza. Drug resistance in parasitic helminths of veterinary importance in Chile: status review and research needs. Austral J Vet Sci 50, 65-76 (2018)
- Mohey A. Hassanain, Raafat M. Shaapan, Sanaa K.A. Abou-El-Dobal. Synergictic anthelmintic effect of Citrus aurantifolia Swingle Seeds and Mebendazole in Egyptian Dogs infected with Ancylostoma caninum and Toxocara canis: Trial to solve Drug Resistance Problem. International Journal of Research Studies in Biosciences. 2015. 3(9): 104-111
- Nguyen HT, Miyamoto A, Nguyen HTT, Nguyen VT. A study on anthelmintic and antibacterial effects of extracts from chinese honeysuckle (Quisqualis indica L) seeds and areca (Areca catechu) nuts. Asian J Pharm Clin Res, Vol 12, Issue 6, 2019, 88-92.
- Nguyen, H.T.; Wu, S.; Ootawa, T.; Nguyen, H.C.; Tran, H.T.; Pothinuch, P.; Pham, H.T.T.; Do, A.T.H.; Hoang, H.T.; Islam, M.Z.; et al. Effects of Roasting Conditions on Antibacterial Properties of Vietnamese Turmeric (Curcuma longa) Rhizomes. Molecules2023, 28, 7242.
- Nguyen Thanh Hai, Nguyen Van Thanh, Bui Thi Tho, Miyamoto Atsushi. A study about anthelmintic effect of Punica gramatum bark on veterinary endoparasites. Asian. J. Pharm. Clin. Res. ISSN: 0974-2441. 2014. 7: 148-152.
- Nguyễn Như Viên. 1975. Sách hướng dẫn thí nghiệm dược lý (lưu hành nội bộ). Bộ môn Nội – Chẩn – Dược, khoa Thú y, Học viện Nông nghiệp Việt Nam.
- Nguyen Van Thanh, Nguyen Thanh Hai. Study on the inhibition effects of some Vietnamese traditional medicinal plants on egg hatching and larval movement of goat Haemonchus contortus. International Journal of Medicinal Plants Research. ISSN: 2169-303X. 2015. 4: 309-313.
- Shalaby HA, El Namaky AH, Kamel ROA, Derbala AA. Tegumental surface changes in adult Paramphistomum microbothrium (Fischoeder 1901) following in vitro administration of artemether. J Helminthol. 2010; 85: 115-122
- Shalaby HA, El Namaky AH, Khalil FA, Kandil OM. Efficacy of methanolic extract of Balanites aegyptiaca fruit on Toxocara vitulorum. Vet Parasitol. 2012; 183: 386-392
- Viện Dược liệu. 1999. Selected Medicinal Plants in Vietnam. Vol 2. Nhà xuất bản Khoa học Công nghệ. Trang: 156-158.
- Waller PJ. 2006a . From discovery to development: current industry perspectives for the development of novel methods of helminth control in livestock. Vet Parasitol 139, 1-14.
- Waller PJ. 2006b. Sustainable nematode parasite control strategies for ruminant livestock by grazing management and biological control. Anim Feed Sci Technol 126, 277-289.
- Woodgate RG, Cornell AJ, Sangster NC. 2017. Occurrence, measurement and clinical perspectives of drug resistance in important parasitic helminths of livestock. In: Mayers DL, Sobel JD, Ouellette M, Kaye KS, Marchaim D (eds). Antimicrobial Drug Resistance: Volume 2. Springer, Switzerland, Pp 1305-1326.
- Yamson EC, Tubalinal GASP, Viloria VV, Mingala CN. Anthelmintic effect of betel nut (Areca catechu) and neem (Azadirachta indica) extract against liver fluke (Fasciola spp.). J Adv Vet Anim Res 2019; 6(1):44–49


 English
English