SỰ LƯU HÀNH CỦA BOVINE ROTAVIRUS (BRV) VÀ BOVINE CORONAVIRUS (BCOV) Ở BÒ NUÔI TẠI MỘT SỐ TỈNH
MIỀN BẮC VIỆT NAM
Lê Văn Trường1*, Huỳnh Thị Mỹ Lệ1, Lê Văn Phan1, Trần Thị Hương Giang1,
Võ Văn Hiểu1, Vũ Thị Ngọc1
1 Bộ môn Vi sinh vật – Truyền nhiễm, Khoa Thú y,
Học viện Nông nghiệp Việt Nam
* Tác giả liên hệ: lvtruong@vnua.edu.vn
TÓM TẮT
Bovine Rotavirrus (BRV), Bovine Coronavirus (BCoV) là các tác nhân chính gây tiêu chảy ở bò, làm thiệt hai kinh tế rất lớn cho ngành chăn nuôi bò ở nước ta. Nghiên cứu này nhằm mục đích xác định sự lưu hành của BRV và BCoV ở bò nuôi tại một số tỉnh miền Bắc Việt Nam. Phương pháp test nhanh mẫu phân và RT-PCR được sử dụng để phát hiện BRV và BCoV trong các mẫu phân thu thập được. Kết quả nghiên cứu cho thấy có đến 13,97% và 17,2% số mẫu phân bò tiêu chảy lần lượt dương tính với BCoV và BRV. Nhóm bê con có tỷ lệ dương tính với BCoV và BRV cao hơn các nhóm bò khác, với tỷ lệ dương tính lần lượt là 19.64% và 25%.
Từ khóa: Bovine Rotavirrus (BRV), Bovine Coronavirus (BCoV), Bò, Test nhanh, RT-PCR
Prevalence of Bovine Rotavirus (BRV) and Bovine Coronavirus (BCoV) in Cattle Raised in some Provinces in the North of Vietnam
ABSTRACT
Bovine Rotavirus (BRV), Bovine Coronavirus (BCoV) are the main causative agents of diarrhea in cattle. This study aims to determine the prevalence of BRV and BCoV in cattle in some northern provinces of Vietnam. Rapid test methods and RT-PCR were used to detect BRV and BCoV in collected samples. The study results showed that up to 13.97% and 17.2% of cow feces samples with diarrhea were positive for BCoV and BRV, respectively. The calves group had a higher positive rate for BCoV and BRV than other cow groups, with a positive rate of 19.64% and 25%, respectively.
Key words: Bovine Rotavirrus (BRV), Bovine Coronavirus (BCoV), Cattle, Rapid test, RT-PCR.
- ĐẶT VẤN ĐỀ
Hội chứng tiêu chảy ở bò do virus gây thiệt hại kinh tế nghiêm trọng cho ngành chăn nuôi bò trên toàn thế giới. Bệnh do virus gây ra có tốc độ lây lan nhanh, tỉ lệ mắc và tỉ lệ tử vong cao. Virus gây bệnh tiêu chảy ở bò thường bao gồm các tác nhân chính sau: tiêu chảy do Bovine Rotavirrus (BRV), tiêu chảy do Bovine Coronavirus (BCoV) và tiêu chảy do Bovine Viral Diarrhea virus (BVDV) (Reynolds & cs., 1985; Saif & Smith., 1985; Snodgrass., 1986). Trong đó, Bovine Coronavirus (BCoV) và Bovine Rotavirus (BRV) là các tác nhân gây bệnh được tìm thấy trên toàn thế giới. Bovine Rotavirus (BRV) là virus thuộc chi Rotavirus, trong họ Reoviridae. BRV là virus có vỏ bao bọc, kích thước 75nm, khối lượng phân tử 12,2×106kDa, genome ARN sợi kép có hình giống như những nan hoa cắm vào trục bánh xe (Junichi & cs., 2013). BRV được chia thành 8 nhóm chính (A-H) (Kinder & cs., 2013). Trong đó, Rotavirus nhóm A được chứng minh là nguyên nhân chính gây bệnh tiêu chảy ở gia súc, mặc dù Rotavirus B và C cũng đã được phát hiện (Cho & cs., 2014). BCoV thuộc nhóm Betacoronavirus, họ Coronaviridae. BCoV là virus có vỏ bọc, hình cầu, đường kính từ 65-210 nm, được phủ một lớp màng hemagglutinin và receptor bề mặt (Clark., 1993). Genome bao gồm một chuỗi đơn có sợi ARN dương chiều dài 32kb với đuôi polyA trong chiều dài. ARN của genome phức hệ với phosphoprotein nucleocapsid (N) hình thành một chuỗi xoắn được tìm thấy dưới lớp màng của virus.
Ở Việt Nam, bệnh tiêu chảy do virus bao gồm cả BCoV, BRV thường xuyên xảy ra và gây ra thiệt hại kinh tế nghiêm trọng cho ngành chăn nuôi bò cả nước. Nghiên cứu của Nguyễn Văn Chào và cộng sự (2014) đã xác định sự có mặt của các mầm bệnh gây tiêu chảy ở bê nuôi trên địa bàn các phường ven thành phố Huế; trong đó có 37,78% mẫu dương tính BRV và 33,33% mẫu dương tính BCoV. Theo tác giả Vũ Thị Ngọc & cs (2022) khi xác định sự có mặt của Rotavirus trong các mẫu phân tiêu chảy của bò nuôi tại Nghệ An và vùng phụ cận bằng phương pháp RT-PCR cho thấy có 29/142 (20,42%) mẫu phân tiêu chảy của bê cho kết quả dương tính với BRV. Còn khi xác định sự có mặt của BCoV gây tiêu chảy ở bò nuôi tại Hà Tĩnh và Nghệ An cho thấy có 14/180 mẫu phân (7,78%) dương tính với BcoV (Vũ Thị Ngọc & cs., 2019). Tuy nhiên, vẫn chưa có nghiên cứu nào xác định sự lưu hành của BCoV và BRV gây tiêu chảy ở đàn bò nuôi tại một số tỉnh miền Bắc Việt Nam. Vì vậy, việc chẩn đoán bệnh tiêu chảy do BCoV và BRV trên đàn bò có ý nghĩa quan trọng trong công tác hỗ trợ phòng – trị bệnh cho đàn vật nuôi. Gần đây, phương pháp Reverse Transcription-Polymerase Chain Reaction (RT-PCR) đã được sử dụng trong việc xác định sự có mặt của BCoV và BRV trong các mẫu bệnh phẩm từ động vật có biểu hiện tiêu chảy chưa rõ nguyên nhân (Gomez & cs., 2017). Mục tiêu của nghiên cứu này nhằm xác định sự lưu hành của Bovine Rotavirus (BRV) và Bovine Coronavirus (BCoV) ở bò nuôi tại một số tỉnh Miền Bắc Việt Nam.
- VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1. Vật liệu nghiên cứu
Mẫu bệnh phẩm là mẫu phân bò bị tiêu chảy, sử dụng kháng sinh trong thời gian dài nhưng không khỏi, được thu thập từ 5 tỉnh gồm Hà Nội, Vĩnh Phúc, Hà Nam, Nam Định, Sơn La. Mẫu được cho vào ống eppendorf bổ sung 1-2 ml dung dịch Phosphate-buffered saline (PBS). Nếu mẫu chưa sử dụng được bảo quản ở – 20oC.
2.2. Phương pháp nghiên cứu
2.2.1. Chẩn đoán nhanh bằng Rapid test kit
Để kiểm tra sự có mặt của BCoV và BRV trong các mẫu phân, trong nghiên cứu này chúng tôi đã tiến hành test nhanh các mẫu bằng kit chẩn đoán nhanh BoviD-5 Ag (BioNote, Hàn Quốc), kit có độ nhạy Cryptosporidium 98,2%, Rotavirus 99,0%, Coronavirus 98,4%, E. coli K 99 97,8% so với PCR; Giardia 92,1% so với ELISA. Thời gian đọc kết quả là 5-10 phút. Mẫu phân được hòa với dung môi đi kèm, sau đó dùng ống nhỏ giọt bằng nhựa đi kèm hoặc hút mẫu bằng pipet, nhỏ 2-3 giọt mẫu phân của bò nghi mắc bệnh vào phần chứa mẫu của kit chẩn đoán. Quan sát sự xuất hiện của các vạch đỏ ở cửa sổ kết quả. Sau 10 phút tiến hành đọc kết quả. Các mẫu lên hai vạch đỏ (C và T) là mẫu phân dương tính với BCoV và BRV. Kết quả âm tính khi chỉ xuất hiện một vạch đỏ (C) trong cửa sổ kết quả.
2.2.2. Phương pháp tách chiết ARN
Sử dụng kit Trizol Reagent (Life technologies, USA), tiến hành cụ thể như sau: Lấy 300 µl mẫu đã xử lý ở trên vào ống eppendorf; Thêm 700 µl Trizol, vortex đều, sau đó spindown, ủ mẫu 1-2 phút ở nhiệt độ phòng; Thêm 200 µl Cloroform, vortex 10 giây; Ly tâm mẫu ở 13000 vòng/phút trong 10 phút, 4°C; Hút 550 µl dịch trong phía trên sang ống eppendorf mới; Bổ sung 550 µl Isopropanol (tỉ lệ 1:1);vortex; ủ -200C trong 10 phút; Ly tâm ở 13000 vòng/phút trong 10 phút ở 4°C; Loại bỏ dịch trên, thu kết tủa; Tủa được rửa bằng 1000 µl 70% Ethanol,sau đó ly tâm lạnh 13000 vòng/phút trong 10 phút; Loại bỏ dịch, tủa được làm khô tự nhiên; Hòa lại cặn trong 30µl nước Nuclease-free water; Bảo quản vật liệu di truyền ở -20°C nếu chưa sử dụng.
2.2.3. Phương pháp thực hiện phản ứng RT-PCR
- Tổng hợp cDNA
cDNA được tổng hợp dựa trên bộ Kit GoScript™ Reverse Transcriptase (Promega, Anh) phản ứng được thực hiện với các thành phần như sau: Bước 1: Random Primer 2 µl, nuclease-free water 8 µl, mẫu RNA 3 µl sau đó ủ ở 65oC/5 phút, Bước 2: M-MLV 5X Reaction Buffer 4 µl, dNTP 2 µl, M-MLV Reverse Transcriptase 1 µl, Thành phần hóa chất ở bước 1 13 µl, tổng thể tích 20 µl. Chu trình nhiệt cho phản ứng: Ủ ban đầu ở 25°C trong 5 phút, tổng hợp sợi cDNA ở 37°C trong 60 phút, dừng phản ứng ở 70°C trong 10 phút, cuối cùng 4°C ∞.
- Phương pháp RT-PCR
cDNA được khuếch đại nhờ phản ứng PCR sử dụng Kit GoTaq® Green Master Mix (Promega, Anh). Kit này chứa Taq DNA – polymerase và các thành phần cần thiết cho quá trình khuếch đại ADN. Thành phần của phản ứng PCR gồm có: nuclease-free water 6,5 µl, Master mix 12,5 µl, dNTP 1 µl, mồi xuôi(10µM) 1 µl, mồi ngược (10µM) 1 µl, cDNA 4 µl. Phản ứng PCR được thực hiện theo chu kỳ nhiệt như sau: Biến tính ở 94°C trong 5 phút, 35 chu kỳ (Gắn mồi ở 53°C trong 1 phút, kéo dài ở 72°C trong 1 phút), hoàn thành ở 72°C trong 10 phút. Trong nghiên cứu này, cặp mồi đặc hiệu để phát hiện BcoV có trình tự như sau: BCo-F1 (TAT AAG AAT ATG GCT GTG TAT CGC) và BCo-R1 (CAG GCG TAA AAT CCT TAC GCT) cò kích thước sản phầm là 460 bp. Cặp mồi đặc hiệu để phát hiện BcoV có trình tự như sau: BRV-F (AAG CCG GCT TTA AAA GAG AGA AT) và BRV-R (GGA TCG AWC CWG TYG GCC AYC CYT) có kích thước sản phẩm là 400 bp. Sản phẩm PCR được điện di trên thạch 1,2% agarose có bổ sung thuốc nhuộm RedSafeTM Nucleic Acid Staining Solution (Intron, Hàn Quốc).
2.2.4. Phương pháp xử lý số liệu
Số liệu được xử lý bằng phần mềm excel và R.
- KẾT QUẢ VÀ THẢO LUẬN
3.1. Kết quả kiểm tra sự có mặt của BCoV và BRV trong các mẫu bệnh phẩm bằng kit chẩn đoán nhanh
Kết quả của kit chẩn đoán nhanh cho thấy, các mẫu dương tính sẽ hiện lên 2 vạch còn mẫu âm tính sẽ chỉ có một vạch, có 11/93 mẫu có kết quả dương tính với BCoV và 15/93 mẫu dương tính với BRV. Thông tin cụ thể về kết quả chẩn đoán nhanh được thể hiện trong Hình 1 và Bảng 1. Kết quả chẩn đoán nhanh cho thấy tỷ lệ các mẫu phân có tỷ lệ dương tính với BRV (16,13%) cao hơn các mẫu phân có tỷ lệ dương tính với BCoV (11,82%).

Hình 1. Kết quả kiểm tra sự có mặt của BRV và BCoV bằng kit chẩn đoán nhanh
Bảng 1. Kết quả chẩn đoán BCoV và BRV bằng kit chẩn đoán nhanh
| Địa điểm | Số mẫu kiểm tra | Số mẫu dương tính | Tỷ lệ dương tính (%) | ||
| BCoV | BRV | BCoV | BRV | ||
| Vĩnh Phúc | 16 | 1 | 3 | 6,25 | 18,75 |
| Sơn La | 6 | 1 | 2 | 16,67 | 33,33 |
| Hà Nội | 14 | 1 | 3 | 7,14 | 21,43 |
| Nam Định | 20 | 2 | 3 | 1,00 | 15 |
| Hà Nam | 37 | 6 | 4 | 16,21 | 10,81 |
| Tổng | 93 | 11 | 15 | 11,82 | 16,13 |
Theo nghiên cứu của Al-Yousif và cộng sự (2001) tại Kansas, Mỹ, tỉ lệ mẫu phân dương tính với Rotavirus là 36/63 mẫu, chiếm 63%. Trong nghiên cứu khác cũng chỉ ra rằng, tỉ lệ mẫu phân dương tính với BCoV và BRV khá cao là 63,6% (Cho & cs., 2012). So với hai nghiên cứu trên, tỉ lệ mẫu dương tính với BRV và BCoV trong nghiên cứu này tương đối thấp, song nó cũng gây ra những ảnh hưởng không nhỏ đến sức khỏe đàn gia súc cũng như gây thiệt hại về kinh tế cho người chăn nuôi.
3.2. Kết quả kiểm tra sự có mặt của BCoV và BRV trong các mẫu bệnh phẩm bằng phản ứng RT-PCR
Bằng việc sử dụng các cặp mồi BCo-F1/BCo-R1 và BRV-F/BRV- được thiết kế đặc hiệu lần lượt để xác định sự có mặt của BCoV và BRV, sản phẩm PCR thu được có kích thước tương ứng là 460 bpvà 400 bp. Kết quả chẩn đoán BCoV và BRV bằng phướng pháp RT-PCR được thể hiện trong hình 2 và 3.
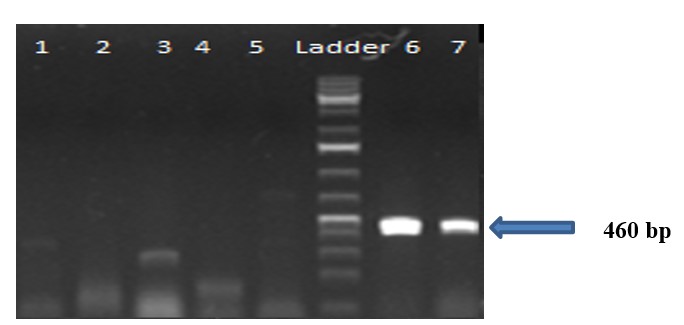
Hình 2. Kết quả chẩn đoán BCoV bằng phương pháp RT-PCR
Ghi chú: giếng 1-7: là các mẫu bệnh phẩm tương ứng; Lad: ladder chuẩn 1 kb, Sản phẩm PCR thu được có kích thước 460 bp
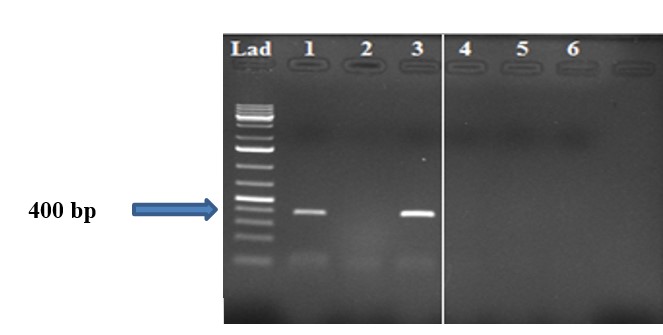
Hình 3. Kết quả chẩn đoán BRV bằng phương pháp RT-PCR
Ghi chú: giếng 1-7: là các mẫu bệnh phẩm tương ứng; Lad: ladder chuẩn 1 kb, Sản phẩm PCR thu được có kích thước 400 bp
Trong nghiên cứu này, 93 mẫu phân của bò bị tiêu chảy nghi mắc BCoV và BRVđã được chẩn đoán bằng phương pháp RT-PCR dùng cặp mồi BCo-F1/BCo-R1 và BRV-F/BRV-R. Kết quả chẩn đoán cho thấy 13/93 mẫu phân (13,97%) cho kết quả dương tính với BCoV và 16/93 mẫu phân chiếm 17,20% (Bảng 2)
Bảng 2. Kết quả chẩn đoán BCoV và BRV bằng phương pháp RT-PCR
| Địa điểm | Số mẫu kiểm tra | Số mẫu dương tính | Tỉ lệ dương tính (%) | ||
| BCoV | BRV | BCoV | BRV | ||
| Vĩnh Phúc | 16 | 1 | 3 | 6,25 | 18,75 |
| Sơn La | 6 | 1 | 2 | 16,67 | 33,33 |
| Hà Nội | 14 | 1 | 3 | 7,14 | 21,43 |
| Nam Định | 20 | 2 | 3 | 1 | 15 |
| Hà Nam | 37 | 6 | 4 | 16,21 | 10,81 |
| Tổng | 93 | 13 | 16 | 13,97 | 17,20 |
Thông qua 2 phương pháp chẩn đoán, ta thấy có sự sai khác về tỉ lệ mẫu dương tính giữa kit chẩn đoán nhanh và phản ứng RT-PCR (Bảng 3).
Bảng 3. So sánh kết quả chẩn đoán BcoV, BRV bằng RT-PCR và kit chẩn đoán nhanh
| Tiêu chí | Kit chẩn đoán nhanh | RT-PCR | ||
| BCoV | BRV | BCoV | BRV | |
| Số mẫu dương tính | 11 | 15 | 13 | 16 |
| Số mẫu âm tính | 82 | 78 | 80 | 77 |
| % số mẫu dương tính | 11,82 | 16,13 | 13,97 | 17,20 |
Kết quả chẩn đoán cho thấy có sự sai khác giữa 2 phương pháp chẩn đoán khác nhau. Theo kết quả của kit chẩn đoán nhanh ta chẩn đoán được 11/93 mẫu dương tính với BCoV và 15/93 mẫu dương tính với BRV. Trong khi đó, bằng RT-PCR chẩn đoán 13/93 mẫu dương tính với BCoV và 16/93 mẫu dương tính với BRV. Sai khác này tuy không lớn nhưng có thể bị ảnh hưởng do nhiều nguyên nhân, có thể nói đến như: nhiễm các mẫu với nhau trong khi tiến hành thí nghiệm test nhanh, do độ nhạy của kit, do sự đặc hiêu của mồi sử dụng trong chẩn đoán,… Mỗi phương pháp có những ưu, nhược điểm nhất định. Kit chẩn đoán nhanh giúp kiểm tra nhanh sự có mặt của virus, tương đối chính xác và dễ dàng sử dụng ngoài thực địa. Ngoài ra, kit còn phát hiện sự có mặt của vi khuẩn E. coli và kí sinh trùng Giardia gây bệnh trên bò. Tuy nhiên, kết quả ở mức tương đối. Bằng RT-PCR, cho độ chính xác cao, song chi phí cao, cần nhiều thời gian. Chính vì thế, cần lựa chọn sử dụng các phương pháp phù hợp trong từng hoàn cảnh cụ thể.
Các nghiên cứu trên thế giới cho thấy, tỉ lệ nhiễm BCoV và BRV ở các nước khác nhau là khác nhau. Kết quả kiểm tra dịch mũi và phân ở bê từ 2-30 ngày tuổi ở 6 trại bò sữa ở Ontario (Canada) cho thấy 91/143 số bê bị tiêu chảy có kết quả dương tính với BCoV (Gomez & cs., 2017). Kết quả nghiên cứu tại 35 ngôi làng ở Thổ Nhĩ Kì cho thấy 13/33 (39,3%) số bê từ 1-30 ngày tuổi và 8/21 (38%) số bê từ 4-12 tháng tuổi bị tiêu chảy có kết quả dương tính với BCoV (Mustafa & cs., 2002). Theo điều tra về sự lưu hành của BRV ở Argentina từ 1994-2010, BRV được phát hiện trong khoảng 56% số dịch tiêu chảy bùng phát (Garaicoechea & cs., 2006; Badaracco & cs., 2012). Ở Nhật Bản, khoảng 19,5% số mẫu thu thập trong giai đoạn 2002 tới 2011 cũng được phát hiện có BRV (Mawatari & cs., 2014). Một báo cáo khác cho thấy, 149/402 mẫu bê tiêu chảy thu thập ở bắc Italy từ 1994 đến 1998 phát hiện dương tính với BRV (Falcone & cs., 1999). Một nghiên cứu ở Iran gần đây cho thấy BRV đã được phát hiện ở 109 mẫu trong tổng số 386 thu thập trong giai đoạn 2010-2012 (Madadgar & cs., 2015). Ở Việt Nam, nghiên cứu của Nguyễn Văn Chào và cộng sự (2014) đã xác định sự có mặt của các mầm bệnh gây tiêu chảy ở bê nuôi trên địa bàn các phường ven thành phố Huế; trong đó có 37,78% mẫu có Rotavirus và 33,33% mẫu có Coronavirus. Theo tác giả Vũ Thị Ngọc & cs (2022) khi xác định sự có mặt của Rotavirus trong các mẫu phân tiêu chảy của bò nuôi tại Nghệ An và vùng phụ cận bằng phương pháp RT-PCR cho thấy có 29/142 (20,42%) mẫu phân tiêu chảy của bê cho kết quả dương tính với BRV. Còn khi xác định sự có mặt của BCoV gây tiêu chảy ở bò nuôi tại Hà Tĩnh và Nghệ An cho thấy có 14/180 mẫu phân (7,78%) dương tính với BcoV (Vũ Thị Ngọc & cs., 2020).
Theo kết quả nghiên cứu này đã cho thấy, có sự lưu hành của BCoV và BRVcó trong các trang trại nuôi bò tại một số tỉnh miền Bắc Việt Nam. Tuy nhiên, tỉ lệ mẫu bệnh dương tính với BCoV và BRV lần lượt là 13,97% (13/93) và 17,20% (16/93) thấp hơn so với các nghiên cứu trên. Sự khác biệt này có thể do việc sử dụng các cặp mồi khác nhau trong các nghiên cứu nên độ nhạy của phản ứng PCR là khác nhau. Mặt khác, yếu tố về không gian, thời gian và địa lí khác nhau cũng dẫn đến tỉ lệ nhiễm BCoV và BRV trên bò là khác nhau.
3.3. Kết quả xác định tỷ lệ lưu hành BcoV và BRV ở đàn bò thuộc các nhóm tuổi khác nhau
Đã có nhiều nghiên cứu trên thế giới cho biết tỷ lệ mẫu phân bò tiêu chảy dương tính với BcoV và BRV là khác nhau ở bò các lứa tuổi khác nhau. Để biết thực tế tỷ lệ dương tính BcoV và BRV với ở bò các lứa tuổi nuôi ở các tỉnh thuộc phạm vi nghiên cứu thế nào, chúng tôi đã tiến hành kiểm tra tỷ lệ dương tính với BcoV và BRV ở các nhóm bê; bò thịt và bò sinh sản. Kết quả được trình bày ở Bảng 4. Qua bảng 4 cho thấy ở nhóm bê có số lượng con mắc BcoV và BRV cao nhất lần lượt là 11/56 và 14/56 con; còn ở các nhóm khác thì số lượng mắc thấp hơn, điều này có thể lý giải là do bê mới sinh ra sức đề kháng yếu, nên dễ bị nhiễm bệnh hơn, còn các nhóm bò khác do có khả năng đề kháng cao nên số con mắc thấp hơn. Không có sự sai khác về tỷ lệ mắc BcoV và BRV ở các nhóm bò khác nhau (P>0,05).
Bảng 4. Kết quả kiểm tra BcoV và BRV ở các nhóm tuổi bò
| TT | Nguồn gốc mẫu | Số mẫu kiểm tra | Số mẫu dương tính | Tỷ lệ dương tính | ||
| BCoV | BRV | BCoV | BRV | |||
| 1 | Bê | 56 | 11 | 14 | 11/56 (19,64%) | 14/56 (25%) |
| 2 | Bò thịt | 27 | 2 | 2 | *2/27 (7,4%) | 2/27 (7,4%) |
| 3 | Bò sinh sản | 10 | 0 | 0 | 0/10 (0%) | 0/10 (0%) |
| Tổng | 93 | 13 | 16 | 13/93 (13,98%) | 16/93 (17,2%) | |
* P < 0,05
Bệnh này không chỉ ảnh hưởng đến bê mới sinh với các triệu chứng như tiêu chảy, tỷ lệ chết cao…mà còn ảnh hưởng đến cả bò trưởng thành với biểu hiện như tiêu chảy tương tự, ảnh hưởng đến khả năng hấp thu thức ăn và sinh trưởng. Đây là bệnh truyền nhiễm xảy ra ở mọi lứa tuổi của bò với đặc trưng là gây tổn thương niêm mạc đường tiêu hoá, triệu chứng đặc trưng là con vật ỉa chảy, có thể kết hợp viêm phổi.Bệnh xảy ra ở bò mọi lứa tuổi bò nhưng bê dưới 2 tháng tuổi thường mẫn cảm hơn.
So sánh thấy tỷ lệ nhiễm BcoV và BRV theo độ tuổi bê nuôi tại một số tỉnh Miền Bắc Việt Nam trong nghiên cứu này lần lượt là 25% và 19.64% so với tình hình nhiễm virus ở các nước trên thế giới là khác nhau. Theo tác giả Vũ Thị Ngọc & cs (2020) và (2022) cho thấy nhóm bê dưới 1 tháng tuổi có tỷ lệ nhiễm BcoV và BRV cao nhất so với các lứa tuổi khác. Ở phía Tây Algeria (Bắc Phi) tỷ lệ nhiễm BcoV và BRV ở bê là thấp hơn, lần lượt là 20,73% và 14,63%. Tỷ lệ nhiễm BRV ở Nhật bản là gần tương đương: 19.5%, (Mawatari & cs., 2014). Một báo cáo khác cho thấy, tỷ lệ nhiễm BRV ở bắc Italy với mẫu thu thập từ 1994 đến 1998 lại cao hơn, chiếm 37,02% với số mẫu dương tính là 149/402 mẫu bê tiêu chảy (Falcone & cs.,1999). So sánh được sự khác biệt về tỷ lệ nhiễm BcoV, BRV của đàn bò ở một số tỉnh miền Bắc Việt Nam so với các nghiên cứu đã từng được công bố trước đó. Nhưng nhìn chung các nghiên cứu đều có điểm chung là đưa ra kết luận nhóm bê con có tỷ lệ dương tính với BRV và BCoV cao nhất.
- KẾT LUẬN
Kết quả nghiên cứu đã chỉ ra rằng có sự lưu hành của 2 loại virus BCoV và BRV ở bò nuôi tại một số tỉnh Miền Bắc Việt Nam. Có đến 13,97% và 17,2% số mẫu phân lần lượt dương tính với BCoV và BRV. Nhóm bê con có tỷ lệ dương tính với BCoV và BRV cao hơn các nhóm bò khác, với tỷ lệ dương tính lần lượt là 19,64% và 25%.
TÀI LIỆU THAM KHẢO
Badaracco, A., L Garaicoechea, D Rodríguez, E Louge Uriarte, A Odeón, G Bilbao, R Galarza, A Abdala, F Fernandez, V Parreño. (2012). “Bovine rotavirus strains circulating in beef and dairy herds in Argentina from 2004 to 2010.” Vet Microbiol 158(3): 394-399.
Cho, Y.I., and Yoon, K.J. (2014). An overview of calf diarrhea-infectious etiology, diagnosis, and intervention. J Vet Sci, 15(1), 1-17.
Cho, K.O., Hasoksuz, M., Nielsen, P.R., Chang, K.O., Lathrop, S., Saif, L.J. (2001). Cross-protection studies between respiratory and calf diarrhea and winter dysentery coronavirus strains in calves and RT-PCR and nested PCR for their detection. Arch Virol. 146(12): p. 2401-19.
Cho, Y.I.,& cs. (2012). Evaluation of a commercial rapid test kit for detecting bovine enteric pathogens in feces. J Vet Diagn Invest, 2012. 24(3): p. 559-62.
Clark, M.A. (1993). Bovine coronavirus. Br Vet J. 149(1): p. 51-70.
Garaicoechea, L., Bok, K., Jones, L.R., Combessies, G., Odeón, A., Fernandez, F., Parreño, V. (2006). Molecular characterization of bovine rotavirus circulating in beef and dairy herds in Argentina during a 10-year period (1994-2003). Vet Microbiol 118(1-2): 1-11.
Gomez, D.E., Arroyo, L.G., Poljak Z., Viel L., Weese J.S. (2017). Detection of Bovine Coronavirus in Healthy and Diarrheic Dairy Calves. J Vet Intern Med. 31(6): p. 1884-1891.
Junichi S., Hiroshi T., Takeshi M., Goro S., Takashi S. & Tohru S. (2013). Whole-genome analysis of two bovine Rotavirus C strains: Shintoku and Toyama. J Gen Virol. 94(1):128-135.
Kindler E., E. Trojnar, G. Heckel, P. H. Otto, and R. Johne. (2013). Analysis of rotavirus species diversity and evolution including the newly determined full-length genome sequences of rotavirus F and G. Infection, Genetics and Evolution, 14, 58-67.
Madadgar, O., Ahmad Nazaktabar., Hadi Keivanfar ., Taghi Zahraei Salehi ., Samad Lotfollah Zadeh. (2015). Genotyping and determining the distribution of prevalent G and P types of group A bovine rotaviruses between 2010 and 2012 in Iran. Vet Microbiol 179(3): 190-196.
Mawatari, T., Kaori Hirano, Hidetoshi Ikeda, Hiroshi Tsunemitsu, Tohru Suzuki. (2014). Surveillance of diarrhea‐causing pathogens in dairy and beef cows in Yamagata Prefecture, Japan from 2002 to 2011.Microbiol Immunol 58(9): 530-535.
Mustafa Hasoksuz , Armando E Hoet, Steven C Loerch, Thomas E Wittum, Paul R Nielsen, Linda J Saif. (2002). Detection of respiratory and enteric shedding of bovine coronaviruses in cattle in an Ohio feedlot. J Vet Diagn Invest. 14(4): p. 308-13.
Nguyễn Văn Chào, Nguyễn Xuân Hòa, Phan Vũ Hải & P. H. S. Hưng. (2014). Ứng dụng phương pháp ELISA xác định nguyên nhân gây tiêu chảy ở bê nuôi trên địa bàn các phường ven thành phố Huế. Tạp chí khoa học, Đại học Huế, 94(6).
Reynolds D.J., Debney T.G., Hall G.A., Thomas L.H., Parsons K.R. (1985). Studies on the relationship between coronaviruses from the intestinal and respiratory tracts of calves. Arch Virol. 85(1-2): p. 71-83.
Saif, L.J. and K.L. Smith. (1985). Enteric viral infections of calves and passive immunity. J Dairy Sci. 68(1): p. 206-28.
Snodgrass, D.R. (1986). Evaluation of a combined rotavirus and enterotoxigenic Escherichia coli vaccine in cattle. Vet Rec. 119(2): p. 39-42.
Vũ Thị Ngọc, Bùi Thị Phương Thảo, Huỳnh Thị Mỹ Lệ, Nguyễn Văn Giáp, Lê Văn Trường, Cao Thị Bích Phượng, Lê Văn Phan. (2019). Nghiên cứu sự lưu hành của Bovine coronavirus gây tiêu chảy ở bò tại Hà Tĩnh và Nghệ An. Tạp chí Khoa học Nông nghiệp Việt Nam, 17(11): 916-924.
Vũ Thị Ngọc, Huỳnh Thị Mỹ Lệ, Lê Văn Phan, Mai Thị Ngân, Trần Thị Hương Giang, Nguyễn Văn Giáp, Đặng Hữu Anh, Lê Văn Trường, Bùi Thị Phương Thảo. (2022). Nghiên cứu sự lưu hành của Rotavirus gây tiêu chảy ở bò tại Nghệ An và vùng phụ cận. Tạp chí Khoa học Nông nghiệp Việt Nam, 20(7): 883-891.


 English
English