Tác nhân gây nên bệnh LMLM là virus thuộc giống Aphthovirus (Aphtho có nghĩa là ‘‘mụn nước’’), họ Picornaviridae. Virus gây nên các triệu chứng lâm sàng như mụn nước, loét trong và xung quanh khoang miệng – mũi, núm vú và bàn chân. Virus có 7 serotype (A, O, C, Asia 1, SAT-1, SAT-2, và SAT-3) được xác định bằng phương pháp huyết thanh học và nhiều subtype (dưới type) trong mỗi kiểu serotype (Bachrach, 1968). Virus LMLM là loại virus nhỏ với một sợi ARN dương bao gồm khoảng 8.000 nucleotide và có bốn protein cấu trúc gồm VP1, VP2, VP3, và VP4. Vùng gen VP1 có tỷ lệ đột biến cao và tính không ổn định di truyền của virus. Protein do gen VP1 mã hoá ra là kháng nguyên chính của các serotype/subtype rất quan trọng trong việc tạo ra các phản ứng miễn dịch đặc hiệu.
Phân loại: Virus thuộc giống Aphthovirus họ Picornaviridae, là một RNA virus có vỏ bọc.
Dưới kính hiển vi điện tử, các hạt virus có dạng hình cầu với bề mặt nhẵn với đường kính khoảng 25nm (Bachrach, 1968). Cấu trúc của lớp vỏ bọc của một số kiểu huyết thanh được xác định bằng kỹ thuật tinh thể tia X (X – ray Crystallography). Trong suốt thế kỷ 20, nhờ sự tập trung của các nghiên cứu về LMLM, Acharya & cs. (1989) đã đưa ra cấu trúc hệ gen (genome) và cấu trúc vật lý của virus LMLM dưới dạng cấu trúc 3 chiều được thể hiện ở hình 2.1.
Ghi chú: (a) Một vùng protein khởi đầu phiên mã làm nổi bật các chuỗi protein Beta xếp dạng thùng (Beta barrel) lặp lại. (b) Một protein 5 đơn vị hình sao. (c) Cấu tạo của hạt virus hoàn chỉnh với cấu trúc lặp G-H (màu vàng) và chuỗi trình tự RGD (màu trắng). (d) Một vùng protein khởi đầu phiên mã với cấu trúc lặp G-H (màu tím) và chuỗi trình tự RGD (màu vàng). Toàn bộ các cấu trúc trong hình đại diện cho hạt virus trưởng thành (bao gồm protein VP0 đã được cắt), protein VP1 (màu xanh dương), VP2 (xanh lá), VP3 (màu đỏ), protein VP4 nằm ở mặt trong của hạt virus và chỉ có thể được quan sát ở hình (a) màu vàng. Nguồn: Acharya & cs., 1989; Logan & cs., 1993
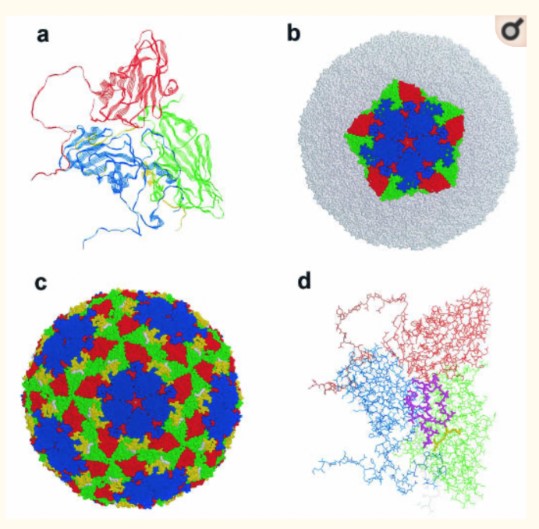
Hình 1. Cấu tạo của hạt virus trưởng thành thuộc kiểu huyết thanh type O
Các protein cấu trúc VP1, VP2 và VP3 được gấp thành các chuỗi Beta 8 sợi xếp dạng thùng dựa trên cấu trúc hình nêm. Các protein cấu trúc có kích cỡ vừa đủ để xếp cạnh nhau, tạo nên lớp cấu trúc vỏ bọc (Hình 2.1a) (Acharya & cs., 1989). Vị trí protein VP4 bị ba protein VP1, VP2, và VP3 che lấp vào bên trong. VP4 chứa một nhóm myristyl (C14H30O) liên kết cộng hoá trị với đầu tận cùng N (Chow & cs., 1987; Belsham & cs., 1991). Các sợi của chuỗi Beta nối với nhau theo vòng lặp của chính các sợi này và từ đó tạo ra một mặt khác của hạt virus (Hình 2.1d) (Jackson & cs., 2003). Các mặt của virus giúp nhà khoa học phân biệt giữa virus LMLM và các Enterovirus, Cardiovirus khác nằm ở chỗ trên bề mặt của virus LMLM không có các cấu trúc “lỗ”, các cấu trúc này đóng vai trò làm vị trí bám cho thụ thể của Enterovirus và Cardiovirus (Belnap & cs., 2000). Một đặc điểm cấu trúc nữa của virus LMLM chính là sự xuất hiện của một cổng tại vị trí của cấu trúc ngôi sao năm cánh, cho phép các phân tử nhỏ như CsCl đi qua lớp vỏ bọc, điều này khiến virus LMLM có tỷ trọng nổi lớn nhất trong số các thành viên của họ Picornaviridae (Hình 2.1b–c) (Acharya & cs., 1989; Jackson & cs., 2003).
Không giống như các thành viên khác trong họ Picornaviridae, lớp vỏ bọc của virus LMLM khi tiếp xúc với môi trường có nồng độ pH nhỏ hơn 6,5 sẽ bị tách thành các cấu trúc tiểu đơn vị protein pentamer 12S (Brown & Cartwright, 1961). Nguyên nhân gây ra sự không ổn định này đến từ cụm Histidine nằm ở mặt tiếp xúc của protein VP2 và VP3. Khi gặp môi trường có nồng độ pH thấp, các gốc Histidine này sẽ bị proton hoá, từ đó cấu trúc vỏ bọc sẽ bị suy yếu bởi lực đẩy tĩnh điện (Curry & cs., 1995; Ellard & cs., 1999). Sự bất ổn định này dẫn đến sự khác nhau trong cơ chế thoát vỏ sau khi đã xâm nhập tế bào của Picornaviridae và có thể cũng đóng vai trò trong việc chọn lựa tế bào đích (mô và nội tạng) của vật chủ.
Hạt virus mang cấu trúc 140S bao gồm một sợi đơn dương ARN và 60 bản sao cho mỗi protein cấu trúc VP1 (1D), VP2 (1B), VP3 (1C), và VP4 (1A). Nhìn chung, hệ gen của virus LMLM mang các đặc tính cơ bản như các thành viên khác trong họ Picornaviridae. Cách đặt tên cho các protein của virus LMLM được Rueckert và Wimmer công bố năm 1984 (Rueckert & Wimmer, 1984). Bên trong hạt virus có một lượng nhỏ các tiền protein của VP2 (1B) và VP4 (1A) là VP0 (1AB) (Rueckert, 1996). Ngoài ra, hệ gen của virus LMLM còn chứa một bản sao của protein 3B (VPg) (23-24 axit amin) liên kết hoá trị với đầu tận cùng amin ở đầu 5’ (Grubman, 1980). ARN được dịch mã, từ một khung đọc mở (Open Reading Frame – ORF) đơn mã hóa chuỗi polyprotein, theo sau là các phản ứng cắt protein, tạo ra các protein trung gian, các protein cấu trúc (Structural protein – SP ) và các protein phi cấu trúc (nonstructural protein-NSP) (Grubman & cs., 1984; Rueckert & Wimmer, 1984).
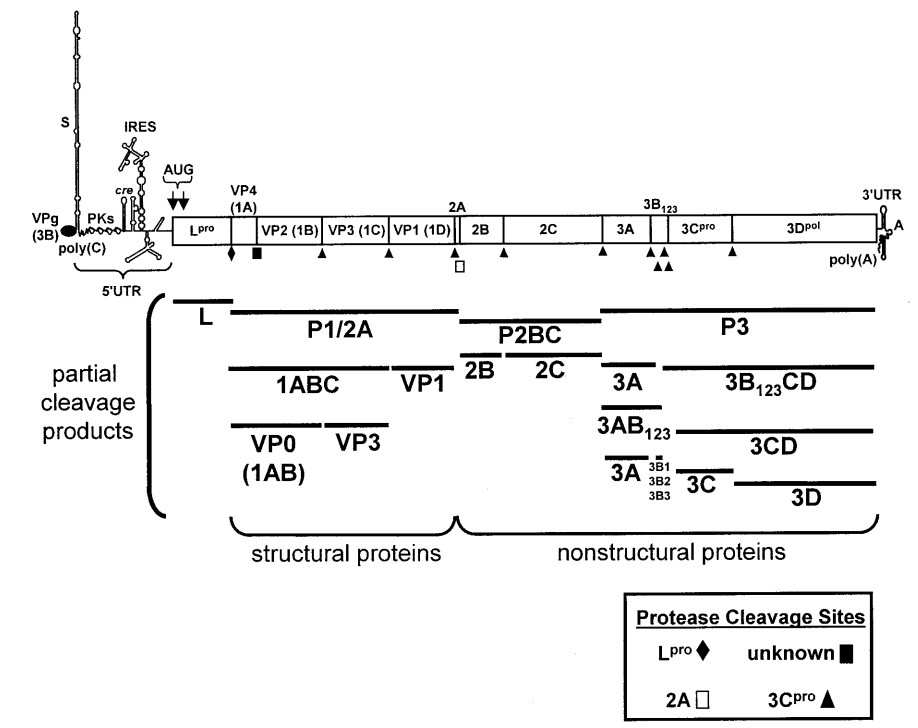
Ghi chú: Partial cleavage products: các sản phẩm phân cắt từng phần; Structural proteins: các loại protein cấu trúc; Nonstructural proteins: các loại protein phi cấu trúc; Protease clevavage sites: các enzym proteaza cắt; unknown: Chưa được biết đến.
Nguồn: Liu & cs., 2015
Hình 2.2. Sơ đồ hệ gen của virus LMLM
Hệ gen của virus LMLM bao gồm vùng ARN khởi đầu không dịch mã (5’-UTR) và vùng ARN kết thúc không dịch mã (3’-UTR) (Hình 2.2). Vùng 5’-UTR chứa khoảng 1.300 bazơ nitơ (Forss & cs., 1984) và có thể được chia thành năm nhân tố chức năng đóng vai trò dịch mã và nhân bản ARN. Ở vị trí ngoài cùng của vùng 5’-UTR, mảnh S, có hình dạng gấp dài tầm 360 bazơ nitơ (Bunch & cs., 1994; Rodríguez & cs., 2009). Chức năng của mảnh S vẫn chưa được làm rõ nhưng trong nghiên cứu so sánh hệ gen của các Picornavirus khác nhau, mảnh S có thể giữ sự ổn định của hệ gen trong các tế bào bị nhiễm và liên quan tới khả năng bám các protein trong quá trình nhân bản hệ gen (Andino & cs., 1993; Barton & cs., 2001). Cũng có một số các nghiên cứu gợi ý về khả năng mảnh S có ảnh hưởng tới sự hình thành bệnh lý nhưng hiện tại vẫn chưa có bằng chứng trực tiếp cho điều này (Cao & cs., 1991).
Đoạn khung đọc mở được chia làm bốn phần (Hình 2.2). Đầu cuối 5’, vùng L, mã hoá cho đầu tận cùng N, chứa hai bộ ba AUG, hình thành nên hai protein L, Lab, và Lb (Robertson & cs., 1985; Sangar & cs., 1987). Trong các thí nghiệm nuôi cấy virus, mặc dù cả hai loại protein L đều được tổng hợp trong quá trình dịch mã ARN (Beck & cs., 1983) nhưng khi sử dụng kỹ thuật SDM (site-directed mutagenesis) để loại bỏ đoạn mã bộ ba AUG thứ hai thì các bản sao của virus LMLM mất khả năng nhân bản ngay cả khi ARN đã trải qua quá trình phiên mã và được truyền vào tế bào, điều này không xảy ra nếu áp dụng với đoạn mã bộ ba AUG đầu tiên (Cao & cs., 1995). Nhằm củng cố cho kết luận này, Piconne và cộng sự đã thử loại bỏ gen L ra khỏi các hạt virus tổng hợp sẵn và chỉ ra rằng những virus bắt đầu quá trình dịch mã các polyprotein từ vị trí của bộ ba AUG thứ hai mới có thể hình thành nên được các virus có đầy đủ chức năng (Piconne & cs., 1995). Từ các kết quả trên, có thể kết luận rằng protein Lb đóng vai trò sinh học trong việc lây nhiễm các vật chủ là động vật. Protein Lpro (Kleina & Grubman, 1992) có thể tự tạo phản ứng xúc tác và tự chia thành protein từ polyprotein tại đầu tận cùng C (Strebel & Beck, 1986). Dưới sự phân tích cấu trúc bằng kỹ thuật tinh thể tia X, chúng ta biết được phản ứng tự phân chia của protein Lpro có thể xảy ra nhờ vào chính tính chất cấu trúc hoá học của nó, cấu hình trans, các protein tại đầu tận cùng C nằm trong vùng kích hoạt của một phân tử protein Lpro ở vị trí ngay cạnh. Cũng với đặc điểm cấu trúc như vậy, phản ứng tự phân chia của protein Lpro cũng có thể xảy ra nhờ vào cấu hình cis. Protein Lpro cũng đóng vai trò trong việc làm bất hoạt việc tổng hợp protein của vật chủ và được coi là nhân tố quyết định độc lực của virus.
Kế tiếp protein Lpro là vùng protein P1 chứa lần lượt bốn protein cấu trúc VP4, VP2, VP3, và VP1. Sau vùng protein P1 là vùng protein P2 chứa lần lượt ba protein cấu trúc 2A, 2B, 2C và cuối cùng là vùng protein P3 chứa protein phi cấu trúc 3A, ba bản sao của các protein VPg, 3Cpro và 3Dpol (Sun & cs., 2004). Từ ban đầu khi các nhà khoa học cố gắng tìm hiểu về protein của virus LMLM, protein 2A thuộc về vùng protein P2 nhưng sau này nhờ các bằng chứng về di truyền và hoá sinh, các peptide 2A bị chia ra dưới dạng tiền protein P1-2A (Vakharia & cs., 1987; Moffat & cs., 2007). Protein 3Cpro được xác định là một enzyme protease, đóng vai trò trong sự tạo thành nên polyprotein trong khi 3Dpol đóng vai trò làm ARN polymeraza phụ thuộc ARN (Newman & cs., 1979; Bablanian & cs., 1993).
Kế tiếp vị trí mảnh S là đoạn poly(C) chứa đến 90% nucleotide C và một phần nhỏ các nucleotide U và A (Hình 2.2). Phần này chỉ dài tầm 100 base nhưng có sự khác nhau giữa các chủng Aphthovirus (Costa Giomi & cs., 1984; Escarmis & cs., 1992; Rieder & cs., 1993). Vai trò và chức năng của poly(C) trong quá trình nhân lên của virus hiện tại vẫn chưa rõ. Kế tiếp poly(C) là vị trí của chuỗi ARN không chức năng hình nút thắt (Rieder & cs., 1993; Escarmis & cs., 1995).
Vị trí tiếp theo ngay sau chuỗi ARN không chức năng hình nút thắt là cấu trúc lặp ngắn hay còn được gọi là cis-acting replicative element (cre) (Mason & cs., 2002). Cấu trúc cre, đều được xác định có trong hệ gen Rhinovirus, Poliovirus, và Cardiovirus (Lobert & cs., 1999; Goodfellow & cs., 2000; Gerber & cs., 2001) gồm một đoạn trình tự có cấu trúc lặp và đoạn trình tự AAACA nằm trong vùng lặp đó. Trái ngược với vị trí cre khác nhau của các Picornavirus khác, vị trí cre của virus LMLM luôn nằm trong vùng 5’-UTR (Mason & cs., 2002). Đoạn cre có chức năng then chốt trong việc nhân bản hệ gen ARN.
Vùng ở giữa cre và khung đọc mở là một chuỗi cấu trúc nhánh lặp có tính bảo toàn cao, chúng tạo nên cổng IRES (Internal ribosome entry site) (Hình 2.2). Cổng IRES của các Picornaviridae chứa lượng lớn các cấu trúc protein bậc hai và ba. Các protein này được chia thành ba nhóm dựa trên mức bộ bảo toàn trong cấu trúc của chúng (Pilipenko & cs., 1989). Đối với Aphthovirus, cổng IRES có cấu trúc gần giống với Cardiovirus (IRES nhóm 2), dài khoảng 450 bazơ nitơ (Belsham & Brangwyn, 1990; Lopez & Martinez, 2000).
Vùng 3’-UTR, theo sau bởi khung đọc mở chứa bộ ba (codon) kết thúc, chứa một đoạn ngắn ARN có dạng gấp khúc đặc biệt (Pilipenko & cs., 1992) và kế tiếp là đoạn poly(A). Vùng 3’UTR có chức năng quan trọng trong nhân bản hệ gen vì nó có thể bám vào các protein tham gia quá trình nhân bản ARN (Cui & Porter, 1995; Melchers & cs., 1997). Vùng poly(A) có chức năng dịch mã và đóng vai trò nhất định trong quá trình nhân bản ARN của họ Picornaviridae (Barton & cs., 2001; López & cs., 2002).


 English
English